题目内容
18.若NA表示阿佛加德罗常数,下列说法正确的是( )| A. | 1 mol氦气分子中含2NA个氦原子 | |
| B. | 25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1NA | |
| C. | 在标准状况下,22.4L空气中约有NA个气体分子 | |
| D. | 在0℃,101kPa时,22.4L氢气中含有NA个氢原子 |
分析 A、稀有气体为单原子分子,1mol氦气中含有1mol氦原子;
B、pH=13的氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,1L溶液中含有0.1mol氢氧根离子,含有0.05mol钡离子;
C、标准状况下22.4L空气中含有1mol气体分子;
D、在0℃,101kPa为标况下,22.4L氢气的物质的量为1mol,含有2mol氢原子;
解答 解:A、1mol氦气中含有1mol氦原子,含NA个氦原子,故A错误;
B、25℃时,1 L pH=13的Ba(OH)2 溶液中含有0.1mol氢氧根离子,含有0.05mol钡离子,含 Ba2+的数目为0.05NA,故B错误;
C、在标准状况下,22.4L空气中含有的气体的物质的量为1mol,约有NA个气体分子,故C正确;
D、在0℃,101kPa时,22.4L氢气的物质的量为1mol,1mol氢气中含有2mol氢原子,含有2NA个氢原子,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
8.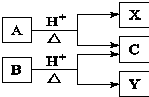 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )| A. | X、Y一定互为同系物 | B. | X、Y的通式一定不同 | ||
| C. | X、Y可能互为同分异构体 | D. | X、Y一定互为同分异构体 |
9.下列离子方程式书写正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
6.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
13.哈伯因发明用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生N2+3H2?2NH3.下列说法正确的是( )
| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 |
10.下列各组中都属于含极性键的非极性分子的是( )
| A. | CO2、H2S | B. | SO3、CH4 | C. | C60、C2H4 | D. | NH3、HCl |
7.下列物质中,能与镁反应并生成氢气的是( )
| A. | CO2 | B. | CH3COOH溶液 | C. | 乙烷 | D. | Na2CO3溶液 |
8.CH2=CHCH2OH可能发生的反应类型有:①加成反应 ②氧化反应 ③取代反应 ④中和反应( )
| A. | 只有①③ | B. | 只有①②③ | C. | 只有①③④ | D. | 只有①② |