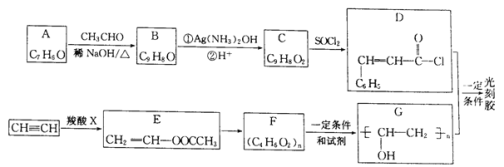
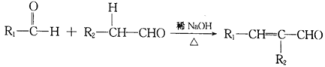
题目内容
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加试剂A,之后改滴试剂B,所得沉淀ymol 与试剂体积V(mL)间的关系。请回答
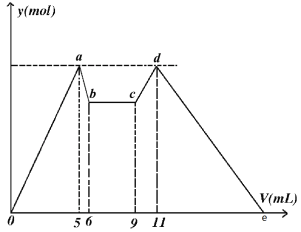
(1)写出c~d段发生反应的离子方程式______________________________________
(2)原溶液中Mg2+、Al3+、Cl的物质的量浓度之比为:_______________________
(3)如果A和B为一元强酸或一元强碱,则c(A):c(B)=_____________________
(4)图中e点处V=_______________(填数字)
【答案】AlO2-+ H++H2O= Al(OH)3↓ 1:1:5 2:1 21
【解析】
根据图像知,MgCl2、AlCl3混合溶液中,开始滴加试剂A,立即产生沉淀,说明A为碱,因为氢氧化铝不能溶于弱碱,因此A为强碱,如NaOH等;ab段应该是强碱溶解氢氧化铝,cd段为偏铝酸根与酸反应生成氢氧化铝沉淀,de段为氢氧化镁和氢氧化铝溶解于酸的过程,因此试剂B为强酸,如HCl等,bc段发生酸碱中和反应。据此分析解答。
(1)根据上述分析,c~d段为偏铝酸根与酸反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+ H++H2O= Al(OH)3↓,故答案为:AlO2-+ H++H2O= Al(OH)3↓;
(2)开始加入碱,生成沉淀与氢氧化铝溶解消耗碱的体积之比为5∶1,设溶解氢氧化铝消耗OH-为1mol,则生成沉淀最大时,消耗OH-为5mol,由Al(OH)3+OH-=AlO2-+2H2O,可知n[Al(OH)3]=n(OH-)=1mol,故n(Al3+)=n[Al(OH)3]=1mol,生成氢氧化铝沉淀消耗OH-为1mol×3=3mol,则生成氢氧化镁消耗OH-为5mol-3mol=2mol,故n[Mg(OH)2]=1mol,则n(Mg2+)=n[Mg(OH)2]=1mol,由电荷守恒可知n(Cl-)=3n(Al3+)+2n(Mg2+)=5mol,故原混合溶液中c(Mg2+)∶c(Al3+)∶c(Cl-)=1∶1∶5,故答案为:1∶1∶5
(3)如果A和B为一元强酸或一元强碱,由(2)中分析可知,溶解氢氧化铝消耗OH-为1mol,n(AlO2-)= n(Al3+)=1mol,由AlO2-+H++H2O=Al(OH)3↓,可知消耗n(H+)=1mol,根据图像,溶解氢氧化铝消耗一元强碱溶液体积与生成氢氧化铝沉淀消耗一元强酸溶液的体积之比为1∶2,则c(A)∶c(B)=2∶1,故答案为:2∶1;
(4)de段为氢氧化镁和氢氧化铝溶解于强酸的过程,由(2)中分析可知,d点含有1mol氢氧化铝和1mol氢氧化镁,溶解1mol氢氧化铝需要消耗3mol H+,溶解1mol氢氧化镁需要消耗2mol H+,因此de段消耗的酸与cd段消耗的酸的物质的量之比为1∶5,则de段消耗的酸与cd段消耗的酸的体积之比为1∶5,因此de段消耗的酸的体积为10mL,因此e点处V=21,故答案为:21。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案