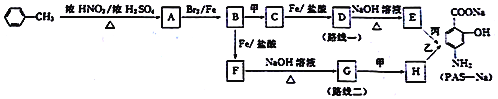
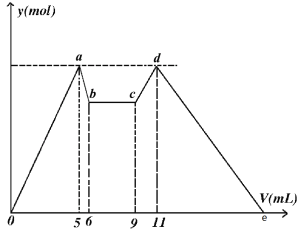
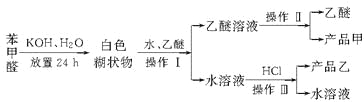
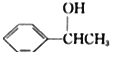
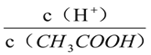题目内容
【题目】(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:__________________________________。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是_____。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
【答案】 正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 a-2<b<a 1×10-8 mol·L-1 中 碱 NH![]()
【解析】(I)①假设现有0.010 mol·L-1氢氧化钠溶液,c(OH-)=0.01 mol·L-1, c(H+)=10-12 mol·L-1,用pH试纸测出pH为12,现用pH试纸测出0.010 mol·L-1氨水的pH为10,所以NH3·H2O是弱电解质,正确;正确答案: 正确; 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 。
②假设氨水为强碱,0.010 mol·L-1氨水pH=a,用蒸馏水稀释至100倍,其pH=b=a-2,现确认NH3·H2O是弱电解质,存在电离平衡,所以a-2<b<a ;正确选项:a-2<b<a。
(II) (1)在pH=6的CH3COOH与CH3COONa的混合溶液中,c(H+)=10-6 mol/L,c(OH-)=10-14/10-6= 1×10-8 mol·L-1,正确答案:1×10-8 mol·L-1。
(2)醋酸和NH3·H2O的电离平衡常数均为1.74×10-5,电离能力相同,所以CH3COONH4溶液中两种离子水解能力相同,溶液呈中性;由CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O反应可知醋酸的酸性大于碳酸的酸性,NH4HCO3溶液中,HCO3-水解能力大于NH4+水解能力,所以溶液显碱性,离子浓度最大为NH4+;正确答案:中; 碱 ; NH![]() 。
。

 53随堂测系列答案
53随堂测系列答案【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。