题目内容
【题目】NaNO2可将正常的血红蛋白中的二价铁变为高铁血红蛋白中的三价铁,失去携氧能力。完成下列填空:
(1)N元素在元素周期表中位于第____族,N原子的结构示意图______________。
(2)Na、N、O三种元素形成的简单离子中,离子半径最小的是_______(用离子符号表示)。
(3)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染。下列试剂中,能使NaNO2转化为N2的是______________(选填编号)。
a.NaCl b.NH4Cl c.HNO3 d.H2SO4
(4)已知NaNO2能发生如下反应:NaNO2 + HI → NO↑+ I2 + NaI + H2O
①配平反应物的系数并标出电子转移的方向和数目__NaNO2 +__ HI → NO↑+ I2 + NaI + H2O 。
②当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)NaNO2外观与食盐相似,根据上述反应,可用于鉴别NaNO2和NaCl。现有 ①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤白醋,其中可选用的物质至少有______(选填编号)。
【答案】 VA 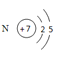 Na+ b
Na+ b  16.8 ②⑤
16.8 ②⑤
【解析】
(1)N元素是7号元素,最外层电子数为5,所以氮位于元素周期表第二周期第VA族,N原子的结构示意图: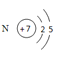 ;
;
(2)Na、N、O三种元素形成的简单离子结构相同,随核电荷数增加,离子半径逐渐减小,故离子半径最小的是Na+;
(3)NaNO2中氮元素的化合价为+3价,使NaNO2中的氮转化为对空气无害的氮气,需要另一种反应物具有强氧化性,而且还有氮元素,二者发生氧化还原反应生成氮气,A、氯离子只有弱还原性,故A错误;B、铵根离子中的氮为-3价,具有强还原性,能够与+3价的氮元素发生氧化还原反应生成氮气,故B正确;C、硝酸中的氮为+5价,具有强氧化性,故C错误;D、浓硫酸具有强氧化性,故D错误;故选B;
(4)①2I-![]() I2,失去2个电子,NaNO2
I2,失去2个电子,NaNO2![]() NO,得到1个电子,根据电子守恒和原子守恒可得目
NO,得到1个电子,根据电子守恒和原子守恒可得目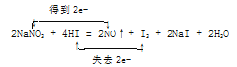 ;②根据方程式2NaNO2 +4HI = 2NO↑+ I2 +2NaI +2H2O可知4mol HI参加反应,有2mol被氧化,生成2mol NO气体,所以当有0.75mol HI被氧化时,有0.75mol NO气体生成V(NO)= 0.75mol×22.4L/mol=16.8L;
;②根据方程式2NaNO2 +4HI = 2NO↑+ I2 +2NaI +2H2O可知4mol HI参加反应,有2mol被氧化,生成2mol NO气体,所以当有0.75mol HI被氧化时,有0.75mol NO气体生成V(NO)= 0.75mol×22.4L/mol=16.8L;
(5)鉴别亚硝酸钠和氯化钠固体,根据题干中的信息:NaNO2能够将HI氧化为I2,I2遇淀粉溶液变蓝,而氯化钠没有该性质,故选②⑤。