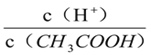题目内容
【题目】将铜片放入0.1mol·L-1FeCl3溶液中,反应一段时间后取出铜片,溶液中![]() ,则反应后溶液中
,则反应后溶液中![]() 与
与![]() 的物质的量之比为 ( )
的物质的量之比为 ( )
A. 3:2 B. 3:4 C. 3:5 D. 4:3
【答案】B
【解析】
铜与FeCl3溶液反应的离子方程式为:2Fe3++Cu=Cu2++2Fe2+,根据铁元素守恒得到:c(Fe2+)+c(Fe3+)=0.1mol·L-1。反应一段时间后取出铜片,溶液中c(Fe2+):c(Fe3+)=2:3,计算得到c(Fe3+)=0.04mol/L,c(Fe2+)=0.06mol/L。根据离子方程式可知:c(Cu2+)=1/2c(Fe2+)=0.03mol/L,相同溶液中,物质的量浓度之比等于物质的量之比,则c(Cu2+):c(Fe3+)=3:4,故B正确。
故选B。

练习册系列答案
相关题目
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。