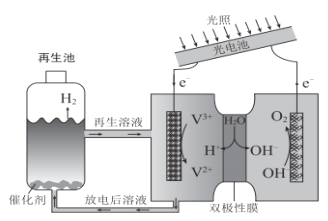
题目内容
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
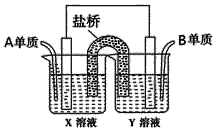
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
【答案】(本小题14分,每空2分)(1)第三周期ⅥA族
(2)离子键、共价键(或非极性共价键) ; 2Na2O2+2H2O===4Na++4OH-+O2↑;
(3)![]() (4) S2-+H2O
(4) S2-+H2O![]() HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
【解析】
试题根据题意可知:A是H;B是O;C是Na;D是S。(1)元素D在周期表中的位置是第三周期ⅥA族;(2)C2B2是Na2O2;属于离子化合物,在所含的化学键类型有离子键、非极性共价键;C2B2与A2B反应的离子方程式是2Na2O2+2H2O===4Na++4OH-+O2↑;(3)元素B、C形成的简单离子电子层结构相同,离子的核电荷数越大,离子半径就越小。所以离子半径较大的是O2-,其电子式是![]() ;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O
;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O![]() HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。