题目内容
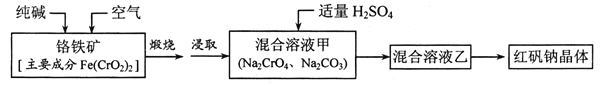
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
【答案】 1s22s22p63s23p63d3或[Ar] 3d3 4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2 2CrO
2Fe2O3+8Na2CrO4+8CO2 2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O CO
+H2O CO![]() +2H+==CO2↑+H2O Fe-2e-==Fe2+ 阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大 16.8
+2H+==CO2↑+H2O Fe-2e-==Fe2+ 阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大 16.8
【解析】流程图中的两个主要反应为4Fe(CrO2)2+7O2+ 8Na2CO3 ![]() 2Fe2O3+8Na2CrO4+8CO2 ,混合溶液甲中的铬酸钠转化为Na2Cr2O7溶液,采取的措施是加硫酸酸化。2CrO
2Fe2O3+8Na2CrO4+8CO2 ,混合溶液甲中的铬酸钠转化为Na2Cr2O7溶液,采取的措施是加硫酸酸化。2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O 。
+H2O 。
(1)Cr为24号元素,失去3个电子形成Cr3+ ,Cr3+ 的基态电子排布式为 1s22s22p63s23p63d3或[Ar] 3d3 ;(2)根据化合价升降Fe(CrO2)2中Fe变1价,Cr变3×2=6价,共变7价,1molO2变4价所以O2前配7,Fe(CrO2)2前配4,其它由质量守恒配平,4Fe(CrO2)2+7O2+ 8Na2CO3 ![]() 2Fe2O3+8Na2CrO4+8CO2 ;(3)溶液甲中加入H2SO4时,2CrO
2Fe2O3+8Na2CrO4+8CO2 ;(3)溶液甲中加入H2SO4时,2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O CO
+H2O CO![]() +2H+==CO2↑+H2O ;(4)①阳极的电极反应式为(不考虑后续反应):铁是活泼金属,参加电极反应,Fe-2e-==Fe2+ ,Cr2O72-+ 14H+ + 6e -= 2Cr3+ + 7H2O ,Fe2+还原Cr2O72―, Cr2O72―+ 14H+ + 6Fe2+ = 2Cr3+ + 7H2O + 6Fe3+,Cr3++ 3OH- = Cr(OH) ; Fe3+ + 3OH-=Fe(OH)3,故阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大;③根据上述反应得关系式,3Fe~Cr,Cr(52.5mg/L-0.5mg/L)×100×103L=5.2×106mg=5.2kg,m(Fe)=
+2H+==CO2↑+H2O ;(4)①阳极的电极反应式为(不考虑后续反应):铁是活泼金属,参加电极反应,Fe-2e-==Fe2+ ,Cr2O72-+ 14H+ + 6e -= 2Cr3+ + 7H2O ,Fe2+还原Cr2O72―, Cr2O72―+ 14H+ + 6Fe2+ = 2Cr3+ + 7H2O + 6Fe3+,Cr3++ 3OH- = Cr(OH) ; Fe3+ + 3OH-=Fe(OH)3,故阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大;③根据上述反应得关系式,3Fe~Cr,Cr(52.5mg/L-0.5mg/L)×100×103L=5.2×106mg=5.2kg,m(Fe)=![]() 。
。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案