题目内容
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
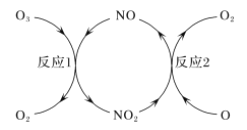
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
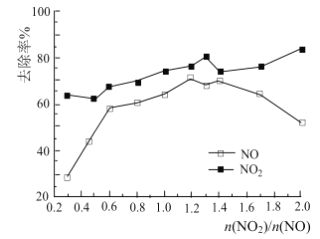
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
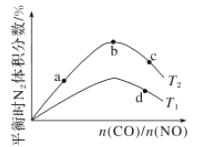
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
【答案】![]() NO2(g)+O(g)=NO(g)+O2(g) △H2=+57.2kJ/mol NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低 1:1 c<b<a b=c>d 60%
NO2(g)+O(g)=NO(g)+O2(g) △H2=+57.2kJ/mol NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低 1:1 c<b<a b=c>d 60%
【解析】
(1)由于活性氧原子变化的速率为零,可认为其生成速率等于消耗速率,以此计算即可;
(2)根据盖斯定律将两个热化学反应相减可得到反应2的热化学方程式;
(3)①NO、NO2和Ca(OH)2发生归中反应产生Ca(NO2)2、H2O;
②根据二者发生归中反应的物质的量的比及NO2与水反应产生HNO3和NO分析判断;
(4)①b点时N2含量最高,说明按方程式计量关系反应,根据方程式分析C、N个数的比;
②根据坐标系中横坐标的含义及物质浓度与物质转化率的关系分析判断。利用化学平衡常数与温度的关系及该反应的正反应为放热反应,利用温度对平衡移动的影响判断;
③根据物质反应转化关系,结合![]() =0.8,反应达平衡时,N2的体积分数为20%,计算平衡时各种物质的浓度,最后根据转化率的含义计算NO的转化率。
=0.8,反应达平衡时,N2的体积分数为20%,计算平衡时各种物质的浓度,最后根据转化率的含义计算NO的转化率。
(1)由于活性氧原子变化的速率为零,可认为其生成速率等于消耗速率,v1=k1c(O3), v2=k2c(O3)·c(O),则k1c(O3)=k2c(O3)·c(O),所以c(O)=![]() ;
;
(2)反应①是O3在NO作用下生成NO2和O2,NO2在氧原子作用下生成NO和O2,反应过程中NO参与反应后又生成,所以NO作用为催化剂,根据盖斯定律将两个热化学反应相减可得到反应2的热化学方程式;NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2 kJ/mol;
(3)①NO和Ca(OH)2不反应,所以反应物有NO、NO2和Ca(OH)2,根据氧化还原规律,产物为Ca(NO2)2和水,所以离子方程式为:NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O;
②当NO太少,NO2量太多,首先发生反应:NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O;NO2不能完全吸收,过量的NO2就和水反应生成HNO3和NO,这样就导致NO2去除率升高,但NO去除率却降低;
(4)①当反应物按化学计量数之比加入时,平衡时的N2的体积分数最大,所以b点的平衡体系中C、N原子个数比接近1:1;
②增大![]() ,CO的浓度增大的倍数大于NO增大的倍数,使CO转化率降低,所以a、b、c三点CO的转化率从小到大的顺序为c<b<a;由于化学平衡常数只与温度有关,所以b、c点的平衡常数相同,该反应的正反应为放热反应,升高温度,化学平衡逆向移动,N2的体积分数减小,所以T1>T2,平衡逆向移动,化学平衡常数减小,故d点平衡常数小于b、c点,所以b、c、d三点的平衡常数从大到小的顺序为b=c>d;
,CO的浓度增大的倍数大于NO增大的倍数,使CO转化率降低,所以a、b、c三点CO的转化率从小到大的顺序为c<b<a;由于化学平衡常数只与温度有关,所以b、c点的平衡常数相同,该反应的正反应为放热反应,升高温度,化学平衡逆向移动,N2的体积分数减小,所以T1>T2,平衡逆向移动,化学平衡常数减小,故d点平衡常数小于b、c点,所以b、c、d三点的平衡常数从大到小的顺序为b=c>d;
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,假设开始时n(NO)=1 mol,n(CO)=0.8 mol,假设CO平衡时CO转化了x mol,则根据物质反应转化关系可知平衡产生CO2的物质的量为x mol,N2为0.5x mol,则此时CO为(0.8-x) mol,NO为(1-x) mol,
=0.8,反应达平衡时,N2的体积分数为20%,假设开始时n(NO)=1 mol,n(CO)=0.8 mol,假设CO平衡时CO转化了x mol,则根据物质反应转化关系可知平衡产生CO2的物质的量为x mol,N2为0.5x mol,则此时CO为(0.8-x) mol,NO为(1-x) mol,![]() ×100%=20%, 解得x=0.6 mol,所以NO的转化率为
×100%=20%, 解得x=0.6 mol,所以NO的转化率为![]() ×100%=60%。
×100%=60%。

 名校课堂系列答案
名校课堂系列答案