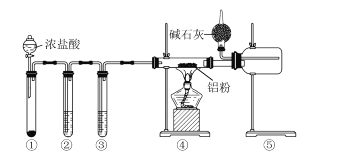
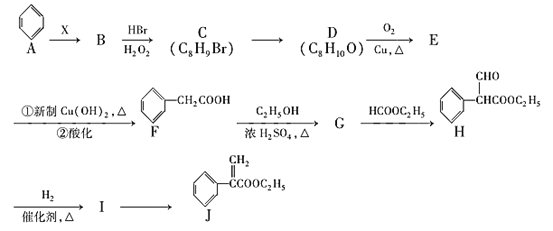
题目内容
【题目】硫化物在自然界中的部分循环关系如图。
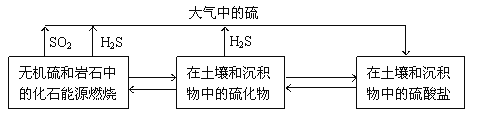
(1)H2S在空气中可以燃烧。
已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.38kJ/mol
S(s)+O2(g)=SO2(g) ΔH=-297.04kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是____。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会____(填“升高”、“不变”或“降低”)。
②为调整海水的pH,可加入新鲜的海水,使其中的HCO3-参与反应,其反应的离子方程式是____。
③在上述反应的同时需要大量鼓入空气,其原因是____。
(3)某科研单位利用工业废气中的SO2来制取H2SO4。
①利用原电池原理,用SO2和O2来制备硫酸,装置如图1所示。B极的电极反应式是____。

②SO2经图2中的两个循环可分别得到S和H2SO4。下列说法正确的是____。
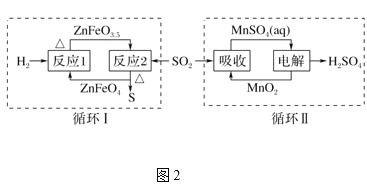
a.循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
b.循环Ⅰ中,反应2的化学方程式为SO2+4ZnFeO3.5![]() S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
d.循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
【答案】2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH=-1036.46kJ/mol 降低 HCO3-+H+=CO2↑+H2O 提高海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3![]() HSO3-+H+、HSO3-
HSO3-+H+、HSO3- ![]() SO32-+H+正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用 SO2-2e-+2H2O=SO42-+4H+ b、d
SO32-+H+正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用 SO2-2e-+2H2O=SO42-+4H+ b、d
【解析】
此题以硫的循环和相关化合物的转化为背景,考查了利用盖斯定律计算反应焓变的方法,以及热化学方程式的书写;同时也从反应原理的角度,考察了速率与平衡以及电化学的内容。
(1)H2S(g)与O2(g)反应生成SO2(g)和H2O(g)的热化学方程式为:![]()
![]() ;由盖斯定律可知该反应的
;由盖斯定律可知该反应的![]() ;
;
(2)①SO2溶于水生成亚硫酸,亚硫酸被氧气氧化后转变为硫酸,溶液的酸性增强,pH值下降;
②由于海水中生成了硫酸,属于强电解质,所以加入新鲜的海水后发生的离子方程式为:![]() ;
;
③通过鼓入大量空气,可以提高海水中溶解氧的含量,加速亚硫酸向硫酸的转化的同时,也提高了二氧化硫的转化率;
(3)①通过分析装置示意图,A极产物为水,说明这一极通入的为O2,那么B极的电极反应即为:![]() ;
;
②通过分析循环Ⅰ,SO2经过反应2后即被还原为S单质,那么反应1即为ZnFeO4还原再生ZnFeO3.5的过程;通过分析循环Ⅱ,SO2先被MnO2吸收转变为MnSO4,这个过程Mn降价而S升价,接着再电解MnSO4溶液分离得到硫酸产品的同时,再生了MnO2;
a.通过分析可知,ZnFeO3.5是反应1的还原产物,a错误;
b.通过分析可知,经过反应2后,SO2被还原为S单质,ZnFeO4被氧化为ZnFeO3.5,方程式正确,b正确;
c.通过分析可知,电解过程Mn从+2价被氧化为+4价,实现再生,因此,阳极材料不能使用Mn单质,c错误;
d.根据硫元素守恒可知,消耗同等质量的SO2,生成S和H2SO4的质量比为16:49,d正确;
答案选bd。

【题目】下列实验方案能达到实验目的的是( )
A | B | C | D | |
实验方案 |
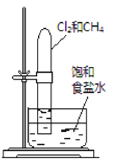
置于光亮处 |
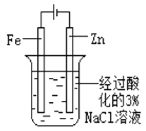
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
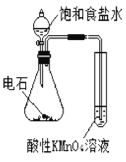
|
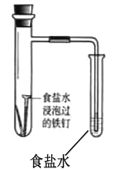
|
实验目的 | 验证甲烷与氯气发生化学反应 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证铁钉发生析氢腐蚀 |
A.AB.BC.CD.D