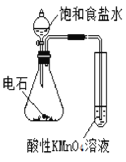
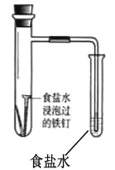
��Ŀ����
����Ŀ��ijͬѧΪ�о�����������������ԭ��Ӧ��Ӱ�����������ʵ�飺
��1���о�![]() ��
��![]() ֮���������ԭ��Ӧ������֪Cr2O72-��ɫ��CrO42-��ɫ��Cr3+��ɫ��
֮���������ԭ��Ӧ������֪Cr2O72-��ɫ��CrO42-��ɫ��Cr3+��ɫ��
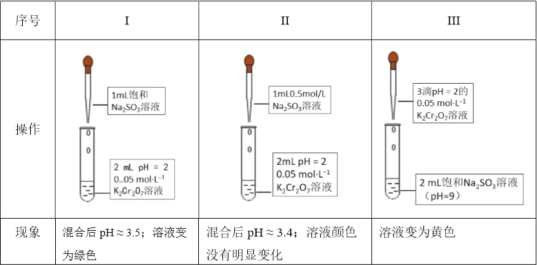
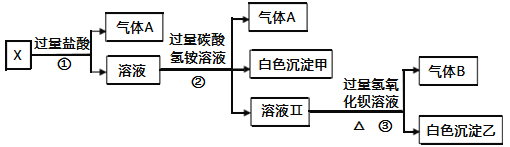
�������ӷ���ʽ����Na2SO3��Һ�Լ��Ե�ԭ��____��
��I��II�Աȵó��Ľ�����____��
�۽��ƽ���ƶ�ԭ������III�е�ʵ������____��
��Ϊ���о�III��I��ʵ�������𣬸�ͬѧ��III�еμ��������ᣨ������ð������������Һ��Ϊ��ɫ������Ϊ��ɫ���Ŀ���ԭ����____��
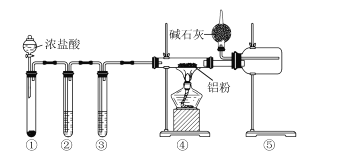
��2��������ͼװ�ã�ͬ����װ�������ɣ��о�Fe3+��I-֮���������ԭ��Ӧ��
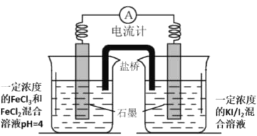
a.��ʼ״ָ̬�벻ƫת
b.����a�������Һ�еμ���������FeCl3��Һ����Ϻ�pH��2.3����ָ��������ƫ
c.����a���Ҳ���Һ�еμӱ���KI��Һ��ָ��������ƫ
��Ϊ��֤��b��������Fe3+Ũ������������������ǿ������������ԭ��Ӧ��Ҫ�����ʵ�����������Ϊ��_____��
�ڸ�ͬѧ�õ��Ȱ�������ձ���Һ���м��Ⱥ�۲쵽������ָ��������ƫ������ԭ����____��
��3��������ʵ���֪��Ӱ��������ԭ��Ӧ��������_____��
���𰸡�SO32-+H2O![]() HSO3-+OH- �����������䣬SO32-Ũ��Խ���仹ԭ��Խǿ Cr2O72-����ɫ��+H2O2
HSO3-+OH- �����������䣬SO32-Ũ��Խ���仹ԭ��Խǿ Cr2O72-����ɫ��+H2O2![]() 2CrO42-����ɫ��+2H+����Һ�д�����SO32-(��OH-)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��� �����������䣬��Һ����ԽǿCr��VI����������ǿ����S��IV����ԭ����ǿ�������ͬʱ��ǿ���������𰸣��������������䣬Cr2O72-�������Ա�CrO42-ǿ�����������²��ܷ�Ӧ�� ��aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת���� �¶����������Fe3+���������� ��Ӧ���Ũ�ȡ��¶ȡ���Һ�������
2CrO42-����ɫ��+2H+����Һ�д�����SO32-(��OH-)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��� �����������䣬��Һ����ԽǿCr��VI����������ǿ����S��IV����ԭ����ǿ�������ͬʱ��ǿ���������𰸣��������������䣬Cr2O72-�������Ա�CrO42-ǿ�����������²��ܷ�Ӧ�� ��aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת���� �¶����������Fe3+���������� ��Ӧ���Ũ�ȡ��¶ȡ���Һ�������
��������
�Ţ�Na2SO3��Һ�Լ�����Ҫ���������ˮ�⣻��I��II�Ա�I��SO32Ũ�ȴ�Ӧ��������ɫ��Cr3+����II��SO32Ũ��С����Һû�����Ա仯���۸���ͼ����Ϣ��ʵ������ó�Cr2O72(��ɫ)+H2O2![]() 2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ����ܸ�ͬѧ��III�еμ���������(������ð��)��������Һ��Ϊ��ɫ��������ǿ�������Cr2O72����������ǿ�����������������ԭ����ǿ�����߷���������ԭ��Ӧ����Cr3+���������
2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ����ܸ�ͬѧ��III�еμ���������(������ð��)��������Һ��Ϊ��ɫ��������ǿ�������Cr2O72����������ǿ�����������������ԭ����ǿ�����߷���������ԭ��Ӧ����Cr3+���������
�Ƣٸ���ͼ����Ϣԭ����Һ��pH =4��ΪpH =2.3��������ǿ��Ϊ��֤��b��������Fe3+Ũ������������������ǿ��Ӧ�ò����Ƿ���������ǿ����ǿFe3+�������ԣ��ڸ�ͬѧ�õ��Ȱ�������ձ���Һ���м��Ⱥ�۲쵽������ָ��������ƫ��˵���¶����߿��������Fe3+���������ԡ�
��������ʵ���֪����Ӧ��Ũ������������ǿ���¶�����Ӧ���ʶ���ӿ졣
�Ţ�Na2SO3��Һ�Լ�����Ҫ���������ˮ�⣬��ԭ����SO32+H2O![]() HSO3��+OH�����ʴ�Ϊ��SO32+H2O
HSO3��+OH�����ʴ�Ϊ��SO32+H2O![]() HSO3�� + OH����
HSO3�� + OH����
��I��II�Ա�I��SO32Ũ�ȴ�Ӧ��������ɫ��Cr3+����II��SO32Ũ��С����Һû�����Ա仯����˵ó��Ľ����������������䣬SO32Ũ��Խ���仹ԭ��Խǿ��
�۸���ͼ����Ϣ��ʵ������ó�Cr2O72(��ɫ)+H2O2![]() 2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ƣ��ʴ�Ϊ��Cr2O72(��ɫ)+H2O2
2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ƣ��ʴ�Ϊ��Cr2O72(��ɫ)+H2O2![]() 2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ơ�
2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ơ�
��Ϊ���о�III��I��ʵ�������𣬸�ͬѧ��III�еμ���������(������ð��)��������Һ��Ϊ��ɫ��������ǿ�������Cr2O72����������ǿ�����������������ԭ����ǿ�����߷���������ԭ��Ӧ����Cr3+����������ʴ�Ϊ�������������䣬��Һ����ԽǿCr(VI)��������ǿ����S(IV)��ԭ����ǿ�������ͬʱ��ǿ(�������𰸣��������������䣬Cr2O72�������Ա�CrO42ǿ�����������²��ܷ�Ӧ)��
�Ƣٸ���ͼ����Ϣԭ����Һ��pH =4��ΪpH =2.3��������ǿ��Ϊ��֤��b��������Fe3+Ũ������������������ǿ��Ӧ�ò����Ƿ���������ǿ����ǿFe3+�������ԣ���˲����ʵ�����������Ϊ����aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת�������ʴ�Ϊ����aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת������
�ڸ�ͬѧ�õ��Ȱ�������ձ���Һ���м��Ⱥ�۲쵽������ָ��������ƫ��˵�������ӱ�Ϊ�������ӣ���˿���ԭ�����¶����������Fe3+���������ԣ��ʴ�Ϊ���¶����������Fe3+���������ԡ�
��������ʵ���֪����Ӧ��Ũ������Ӧ���ʼӿ죬������ǿʹ�÷�Ӧ���ʼӿ죬�¶�����Ӧ���ʼӿ죬�Ӷ��ó�Ӱ��������ԭ��Ӧ�������з�Ӧ���Ũ�ȡ��¶ȡ���Һ������ԣ��ʴ�Ϊ����Ӧ���Ũ�ȡ��¶ȡ���Һ������ԡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
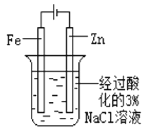
A | B | C | D | |
ʵ�鷽�� |
���ڹ����� |
Ƭ�̺���Fe�缫��������K3[Fe(CN)6]��Һ |
|
|
ʵ��Ŀ�� | ��֤����������������ѧ��Ӧ | ��֤Fe�缫������ | ��֤��Ȳ�Ļ�ԭ�� | ��֤�����������ⸯʴ |
A.AB.BC.CD.D