题目内容
13.饱和氯水中存在平衡:①C12+H2O?H++Cl-+HClO,②HClO?H++ClO-取饱和氯水分别进行下列实验,相应结论错误的是( )| A. | 逐滴加入氨水中,所得溶液中c(H+)逐渐增大 | |
| B. | 继续通入过量C12,①、②均向右移动,溶液pH减小 | |
| C. | 加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动 | |
| D. | 加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
分析 饱和氯水中存在平衡:①C12+H2O?H++Cl-+HClO,②HClO?H++ClO-,浓度的改变能够影响平衡移动,据此分析.
解答 解:A、将饱和氯水逐滴加入氨水中,发生中和反应,氨水碱性减弱,氢离子浓度增大,故A正确;
B、向饱和氯水中通入过量C12,氯气不再溶解,平衡不移动,pH不变,故B错误;
C、碳酸钙能够与氯水中的盐酸反应,碳酸根离子浓度减小,沉淀溶解平衡正向移动,故C正确;
D、向氯水中加入NaOH,若溶液显中性,据电荷守恒c(Cl-)+c(ClO-)=c(Na+),故D正确.
故选B.
点评 本题考查了中和反应、弱电解质的电离平衡的移动、沉淀的溶解平衡、电荷守恒等知识,题目难度不大.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
3.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa、25℃时,H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3KJ |
4.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了27g.常温下各烧杯中溶液的pH与电解时间t的关系如图Ⅱ所示.据此回答下列问题:
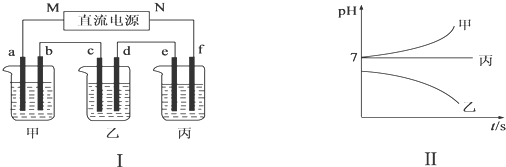
(1)M为电源的负(填“正”或“负”)极,乙中阳离子向c(填“c”或“d”)定向移动,A是NaCl(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积为1.4L.
(3)b电极上发生的电极反应为2Cl--2e-=Cl2↑;乙烧杯的电解池总反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)要使丙恢复到原来的状态,应加入物质的质量为2.25g.
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |

(1)M为电源的负(填“正”或“负”)极,乙中阳离子向c(填“c”或“d”)定向移动,A是NaCl(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积为1.4L.
(3)b电极上发生的电极反应为2Cl--2e-=Cl2↑;乙烧杯的电解池总反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)要使丙恢复到原来的状态,应加入物质的质量为2.25g.
1.关于各图的说法(其中①③④中均为惰性电极)正确的是( )
| A. | 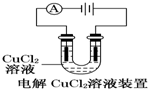 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝 | |
| B. | 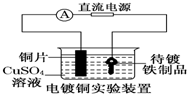 装置中待镀铁制品应与电源正极相连 | |
| C. |  装置中电子由b极流向a极 | |
| D. |  装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
8.短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等.下列判断正确的是( )
| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
5.将SO2和SO3混合气体通入过量的BaCl2溶液中,下列说法中正确的是( )
| A. | 两种气体被完全吸收,并生成BaSO4沉淀 | |
| B. | 两种气体被完全吸收,生成BaSO3和BaSO4沉淀 | |
| C. | 两种气体均不能被吸收,没有沉淀生成 | |
| D. | 只有一种气体被吸收,生成BaSO4沉淀 |
7.不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂组是( )
| A. | 盐酸、硫酸 | B. | 氨水、氢氧化钠溶液 | ||
| C. | 氯化钠溶液、硫酸 | D. | 盐酸、氢氧化钠溶液 |