题目内容
7.不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂组是( )| A. | 盐酸、硫酸 | B. | 氨水、氢氧化钠溶液 | ||
| C. | 氯化钠溶液、硫酸 | D. | 盐酸、氢氧化钠溶液 |
分析 根据离子的检验方法设计,Ag+可用Cl-检验,Ba2+可用SO42-检验,SO32-可用H+离子检验,Mg2+可用OH-离子检验,以此来解答.
解答 解:A.加入盐酸可鉴别AgNO3,生成AgCl沉淀,K2SO3与盐酸反应生成刺激性气味的SO2气体;然后加入硫酸可鉴别BaCl2,生成白色沉淀,故A不选;
B.加入氨水可鉴别AgNO3和Mg(NO3)2,但加入NaOH不能鉴别BaCl2和K2SO3,故B选;
C.加入NaCl,可鉴别AgNO3,生成AgCl沉淀,然后加入硫酸可鉴别BaCl2,生成白色沉淀,K2SO3与硫酸反应生成刺激性气味的SO2气体,与Mg(NO3)2不反应,可鉴别,故C不选;
D.加入盐酸可鉴别AgNO3,生成AgCl沉淀,K2SO3与盐酸反应生成刺激性气味的SO2气体;然后加入NaOH,与Mg(NO3)2反应生成白色沉淀,可鉴别,故D不选;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,注意物质的性质的异同为解答该类题目的关键,鉴别几种物质,应能产生不同的现象,该题较好的综合考查元素化合物知识,侧重分析、实验能力的考查,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
13.饱和氯水中存在平衡:①C12+H2O?H++Cl-+HClO,②HClO?H++ClO-取饱和氯水分别进行下列实验,相应结论错误的是( )
| A. | 逐滴加入氨水中,所得溶液中c(H+)逐渐增大 | |
| B. | 继续通入过量C12,①、②均向右移动,溶液pH减小 | |
| C. | 加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动 | |
| D. | 加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
14.伞形酮可用作荧光指示剂和酸碱指示剂.其合成方法为:
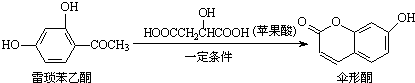
下列有关这三种物质的说法正确的是( )
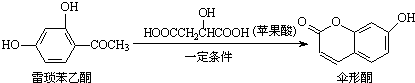
下列有关这三种物质的说法正确的是( )
| A. | 雷琐苯乙酮所有碳原子不可能共平面 | |
| B. | 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应 | |
| C. | 1 mol雷琐苯乙酮跟足量H2反应,最多消耗3 mol H2 | |
| D. | 1 mol伞形酮与足量NaOH溶液反应,最多消耗3 mol NaOH |
11.碲(Te)是与O、S同族的元素,位于第五周期.据此,推断碲的相关性质错误的是( )
| A. | 碲的单质在常温下是固态 | B. | 碲的常见化合价是-2、+4、+6 | ||
| C. | 碲可能作半导体材料 | D. | 碲的氢化物H2Te很稳定 |
19.常温下,pH=8~9的Na2SO3溶液中存在:SO32-+H2O=HSO3-+OH-,下列说法正确的是( )
| A. | c(SO32-)>c(OH-)>c(HSO3-) | B. | c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) | ||
| C. | 加入少量NaOH固体,Kw增大 | D. | 加入稀盐酸,c(HSO3-)减小 |
16.关于硝酸的性质,叙述错误的是( )
| A. | 无色、易挥发,有刺激性气味的液体 | |
| B. | 浓度为98%以上的浓硝酸叫发烟硝酸,具有脱水性 | |
| C. | 浓硝酸通常显黄色,因为溶解了少量的二氧化氮 | |
| D. | 硝酸不稳定,浓度越大越易分解 |
 如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.
如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.