题目内容
8.短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等.下列判断正确的是( )| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
分析 短周期元素甲、乙、丙、丁的原子序数依次增大,乙与丁同族,则乙处于第二周期、丁处于第三周期,甲位于第VA族,原子序数小于乙,故甲为N,乙原子的核外电子数比甲原子多1,则乙为O,可推知丁为S,丙原子最外层电子数与电子层数相等,原子序数大于氧,则丙在第三周期第ⅢA族,即丙为Al,据此解答.
解答 解:短周期元素甲、乙、丙、丁的原子序数依次增大,乙与丁同族,则乙处于第二周期、丁处于第三周期,甲位于第VA族,原子序数小于乙,故甲为N,乙原子的核外电子数比甲原子多1,则乙为O,可推知丁为S,丙原子最外层电子数与电子层数相等,原子序数大于氧,则丙在第三周期第ⅢA族,即丙为Al.
A.同周期原子半径从左向右减小、同主族自上而下原子半径越大,则原子半径为:丙(Al)>丁(S)>乙(O),故A错误;
B.甲为N元素,气体氢化物为NH3,NH3的水溶液呈碱性,故B错误;
C.乙与丙形成的化合物为氧化铝,属于两性氧化物,既能与酸反应,又能与碱反应,故C正确;
D.与丁(S)同周期元素的最高价氧化物对应水化物的酸性最强是高氯酸,故D错误,
故选C.
点评 本题考查原子结构和元素周期律的关系,难度不大,注意元素周期律的递变规律,把握从原子结构的角度如何推断元素的种类.

练习册系列答案
相关题目
18.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )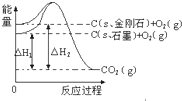

| A. | C(s石墨)=C(s金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 金刚石的稳定性大于石墨 | |
| C. | 石墨和金刚石转化是物理变化 | |
| D. | 1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ |
19.下列叙述正确的是( )
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 甲烷?氨和水都是由极性键结合而成的极性分子 | |
| C. | 金属晶体的熔点一定比原子晶体低,比分子晶体高 | |
| D. | H2O的沸点比H2S高,是因为H2O分子间存在氢键 |
3.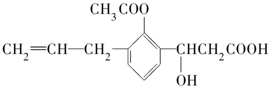 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )
①烯烃 ②多官能团有机化合物
③芳香烃 ④烃的衍生物.
 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )①烯烃 ②多官能团有机化合物
③芳香烃 ④烃的衍生物.
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①③ |
13.饱和氯水中存在平衡:①C12+H2O?H++Cl-+HClO,②HClO?H++ClO-取饱和氯水分别进行下列实验,相应结论错误的是( )
| A. | 逐滴加入氨水中,所得溶液中c(H+)逐渐增大 | |
| B. | 继续通入过量C12,①、②均向右移动,溶液pH减小 | |
| C. | 加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动 | |
| D. | 加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
20.对有机物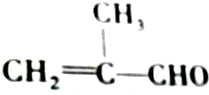 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )
 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )| A. | 既能发生氧化反应,又能发生还原反应 | |
| B. | 1 mol该物质只能与1 mol Br2发生加成反应 | |
| C. | 能发生加聚反应 | |
| D. | 能将新制的Cu(OH)2氧化 |

 .
.