题目内容
3.下列说法或表示方法中正确的是( )| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa、25℃时,H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3KJ |
分析 A、硫蒸气变化为固体硫放出热量;
B、依据能量越高越活泼分析判断;
C、在25℃和101kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热判断;
D、浓硫酸溶解过程是放热过程.
解答 解:A、硫蒸气变化为固体硫放出热量,等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故A错误;
B、由C(石墨)=C(金刚石)△H=+11.9kJ/mol,可知金刚石能量高于石墨,说明金刚石比石墨活泼,故B错误;
C、在25℃和101kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.根据H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧生成的为稳定的液体水,所以热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol,故C错误;
D、在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,因为浓硫酸溶解过程是放热过程,所以放出的热量大于57.3KJ,故D正确;
故选D.
点评 本题考查了反应的能量变化,热化学方程式书写方法,燃烧热、中和热概念分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
13.下列有机物系统命名正确的是( )
| A. | 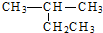 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 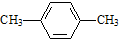 对二甲苯 对二甲苯 | D. | 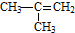 2-甲基-2-丙烯 2-甲基-2-丙烯 |
14.阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解质溶液为KOH溶液,反应保持在较高温度 ,使H2O蒸发,则下列叙述中正确的是( )
| A. | 此电池能发生蓝色火焰 | |
| B. | H2为正极,O2为负极 | |
| C. | 工作时,电解质溶液的pH不断减小 | |
| D. | 电极反应分别为负极:2H2+4 OH--4e-=4 H2O;正极:O2+2 H2O+4e-=4 OH- |
11.下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是( )
| A. | CH3Cl | B. |  | ||
| C. |  | D. | 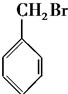 |
18.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )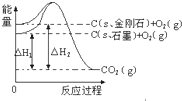

| A. | C(s石墨)=C(s金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 金刚石的稳定性大于石墨 | |
| C. | 石墨和金刚石转化是物理变化 | |
| D. | 1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ |
15.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中的实验现象完成下列问题:
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 浓硝酸 | 偏向Al |
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
12.下列说法中不正确的是 ( )
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要检杏是否漏水,可以用相同的方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的1/2 | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体一半透膜法分离提纯;悬浊液一过滤分离,本质上就是依椐所分离粒子的直径大小选择具有合适孔径的“筛子” |
13.饱和氯水中存在平衡:①C12+H2O?H++Cl-+HClO,②HClO?H++ClO-取饱和氯水分别进行下列实验,相应结论错误的是( )
| A. | 逐滴加入氨水中,所得溶液中c(H+)逐渐增大 | |
| B. | 继续通入过量C12,①、②均向右移动,溶液pH减小 | |
| C. | 加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动 | |
| D. | 加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |