题目内容
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 80g NH4NO3晶体中含有NH4+小于个NA |
分析 A、溶液体积不明确;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、铜只能与浓硫酸反应;
D、1molNH4NO3晶体中含1molNH4+.
解答 解:A、溶液体积不明确,故溶液中的氢离子的个数无法计算,故A错误;
B、过氧化钠由2个钠离子和1个过氧根构成,故1 mol Na2O和Na2O2混合物中含2mol钠离子和1mol阴离子,即3NA个,与Na2O和Na2O2所占的比例无关,故B正确;
C、铜只能与浓硫酸反应,当硫酸变稀后反应即停止,故生成的二氧化硫分子个数小于0.46NA个,故C错误;
D、80gNH4NO3的物质的量为1mol,而1molNH4NO3晶体中含1molNH4+即NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的计算,掌握公式的运用和物质的结构是解题的关键,难度不大.

练习册系列答案
相关题目
1.关于乙烯的化学性质,说法不正确的是( )
| A. | 燃烧时是淡蓝色明亮的火焰 | B. | 能使溴水褪色 | ||
| C. | 可与H2发生加成反应 | D. | 可与HCl加成 |
19.如图所示的四个原电池装置,其中结论正确的是( )
| A. |  Mg作负极,电子流向:Mg一→稀硫酸一→A1 | |
| B. |  Al作负极,电极反应式6H2O+6e-═6OH-+3H2↑ | |
| C. |  Cu作负极,电极反应式Cu-2e-═Cu2+ | |
| D. |  Cu作正极,电极反应式:2H++2e═H2↑ |
3.已经反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
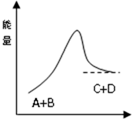

| A. | 铝与稀盐酸的反应符合该图示 | B. | 该反应为吸热反应 | ||
| C. | A的能量一定低于C的能量 | D. | 该反应只有在加热条件下才能进行 |
20.下列解释实验事实的方程式正确的是( )
| A. | Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | 向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-═BaCO3↓+2H2O+CO32- | |
| D. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2+3NO↑+6H2O |

 ;C中所含官能团的名称是羧基、溴原子.
;C中所含官能团的名称是羧基、溴原子.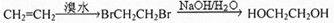 .
.