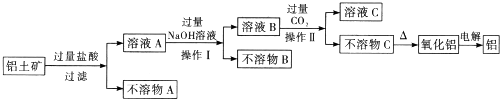
题目内容
16.将标准状况下,33.6L HCl溶于水配成1L溶液求:(1)所配溶液的物质的量浓度;
(2)求溶液中所含H+的浓度;
(3)求溶液中所含H+的个数.
分析 (1)根据n=$\frac{V}{{V}_{m}}$,c=$\frac{n}{V}$计算;
(2)HCl在溶液中完全电离,氢离子的浓度等于HCl的浓度;
(3)根据n(H+)=n(HCl),N=nNA计算.
解答 解:(1)将标准状况下,33.6L HCl溶于水配成1L溶液,n=$\frac{V}{{V}_{m}}$=$\frac{33.6L}{22.4L/mol}$=1.5mol,c=$\frac{n}{V}$=$\frac{1.5mol}{1L}$=1.5mol/L;
答:所配溶液的物质的量浓度为1.5mol/L;
(2)HCl在溶液中完全电离,氢离子的浓度等于HCl的浓度,则溶液中所含H+的浓度为1.5mol/L;
答:溶液中所含H+的浓度为1.5mol/L;
(3)n(H+)=n(HCl)=1.5mol,N=nNA=1.5×NA=1.5NA;
答:溶液中所含H+的个数1.5NA.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意把握HCl在溶液中完全电离的特点.

练习册系列答案
相关题目
6.在一定条件下,能和Br2起反应而且有HBr生成的气体是( )
| A. | 丙烷 | B. | 苯 | C. | 乙烯 | D. | 乙炔 |
7.下面各种能量的转化,其本质属于光能--化学能转换的是( )
| A. | 太阳能热水器、反射式太阳灶 | |
| B. | 太阳能电池 | |
| C. | 利用生活垃圾中生物质能焚烧发电 | |
| D. | 通过植物的光合作用,产生生物质能 |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 80g NH4NO3晶体中含有NH4+小于个NA |
1. 外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )
外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )
 外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )
外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )| A. | p=8.8时,升高温度,反应速率不变 | |
| B. | 保持外界条件不变,反应一段时间后,pH越小,D的浓度越大 | |
| C. | 为了实验取样,可以采用调节pH的方法迅速停止反应 | |
| D. | 减小外界压强,反应速率一定减小 |
8.已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
(1)元素F在元素周期表中的位置是第三周期ⅥA族.这七种元素中,不属于主族元素的元素的名称是氖.
(2)在E、F、G三种元素中,原子半径最小的是Cl(填元素符号).
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为共价键,分子的空间结构为正四面体.A与氧元素可形成化合物AO2,该化合物分子的电子式为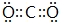 .
.
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈碱(填“酸”、“碱”或“中”)性,原因为NH3•H2O NH4++OH-(用方程式表示)
NH4++OH-(用方程式表示)
| 元素 | 原子结构特征或有关物质的性质 |
| A | 原子的最外层电子数是其内层电子数的2倍 |
| B | 其单质是空气中含量最多的物质 |
| C | 原子的最外层电子数是其电子层数的4倍 |
| D | 位于第ⅡA族,其原子半径比E的大 |
| E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F | 原子序数16,其单质在通常状况下为固体 |
| G | 原子的最外层电子数比其次外层电子数少1个 |
(2)在E、F、G三种元素中,原子半径最小的是Cl(填元素符号).
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为共价键,分子的空间结构为正四面体.A与氧元素可形成化合物AO2,该化合物分子的电子式为
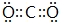 .
.(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈碱(填“酸”、“碱”或“中”)性,原因为NH3•H2O
 NH4++OH-(用方程式表示)
NH4++OH-(用方程式表示)