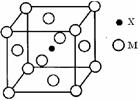
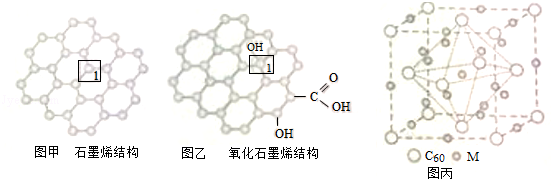
题目内容
(18分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
Na Ar HClO4 NaOH Al(OH)3 Al(OH)3 +3H+ =Al3+ +3H2O
Al(OH)3 +OH― =AlO2-+2H2O 钠 
解析试题分析:同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,以此判断对应的单质、化合物的相关性质。
考点:考查了第三周期元素的性质、单质及其化合物的性质。

(10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是_____________;写出它的氧化物与氢氧化钠反应的离子方程式____________________________________________。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程_________________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为______________________ ,该化合物是由___________ (填“极性”“非极性”)键形成的。
(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。

图3 图4
(6)部分化学键的键能见下表:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。
(10分).
Ⅰ. 下表列出了A~R 9种元素在周期表中的位置(填元素符号):
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(2) A、B、C三种元素按原子半径由大到小的顺序排列为
(3) F元素氢化物的化学式是
(4) G元素跟B元素形成化合物的电子式是
(5) G元素和H元素两者核电荷数之差是
Ⅱ 根据原子结构的有关知识和元素周期律。思考并回答有关114号元素的几个问题。
原子核外有_____个电子层,最外层电子数可能是__________
周期表中位于__________周期,________族
(3) 属于_________元素(填金属或非金属)
(10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
| | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | ⑨ | |
(2)在①②⑤的最高价氧化物的水化物中,碱性最强的是__________(填化学式)。
(3)元素⑦的常见的氢化物的化学式为__ __,该氢化物常温下和元素②的单质反应的离子方程式是:_______________________,该氢化物与元素⑧的单质反应的离子方程式是___________________________。
(4)①和⑨的最高价氧化物对应的水化物化学式分别为___________和_______。
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为__________________
(6)⑧与⑨分别与H2形成的氢化物的稳定性:__________,(用化学式表示)最高价氧化物对应的水溶液的酸性:_______________。(用化学式)
[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式 。
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
| 键长/(pm) | B—F | B—Cl | B—Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
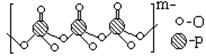
①磷原子的杂化类型为 。
②这种多聚磷酸钠的化学式为 。
(5)已知HF与F-通过氢键结合成HF
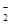 。判断HF
。判断HF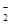 和HF
和HF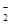 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。。
(15分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | Z的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为 ,其中A的最高价氯化物构成晶体的微粒间作用力为
(3)A和B的最简单氢化物中较稳定的是 (填化学式)。B的最简单氢化物和E的黑色氧化物固体在加热时可反应,写出其反应方程式
(4)E的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出正极反应方程式
(5)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
① AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
② 2BO2(g) ?B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式