题目内容
18.A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同.(1)A与C按原子个数比为1:1形成化合物的电子式是
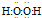 .
.(2)C、E所形成氢化物的稳定性由强到弱的顺序是H2O>H2S(填具体的化学式)
(3)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制新型燃料电池,试写出该电池工作时的化学反应方程式:N2+3H2+2HCl=2NH4Cl;放电时溶液中移向正极的离子有:H+、NH4+
(4)F是一种历史悠久、应用广泛的金属元素.若将F金属投入到盐酸溶液中,生成了浅绿色溶液M.写出M的酸性溶液和C与A形成的一种化合物反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
分析 A、B、C、D、E五种短周期主族元素中,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成的化合物,则A为H元素、D为Na元素、C为O元素;A、B组成的气态化合物的水溶液呈碱性,则B为N元素,E与C的最外层电子数相同,即E、C同主族,E为S,以此来解答.
解答 解:A、B、C、D、E五种短周期主族元素中,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成的化合物,则A为H元素、D为Na元素、C为O元素;A、B组成的气态化合物的水溶液呈碱性,则B为N元素,E与C的最外层电子数相同,即E、C同主族,E为S,
(1)A与C按原子个数比为1:1形成化合物为H2O2,电子式是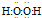 ,故答案为:
,故答案为: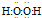 ;
;
(2)非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,为H2O>H2S,故答案为:H2O;H2S;
(3)该电池的正极上氮气得到电子生成铵根离子,则正极反应式N2+6e-+8H+=2NH4+,负极氢气被氧化生成H+,电池反应式为N2+3H2+2HCl=2NH4Cl,放电时,阳离子H+、NH4+向正极移动,
故答案为:N2+3H2+2HCl=2NH4Cl; H+、NH4+;
(4)生成了浅绿色溶液M为氯化亚铁,M的酸性溶液和A与C形成的一种化合物(过氧化氢)发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查位置、结构、性质及应用,为高频考点,把握元素的位置、性质及元素化合物知识推断元素为解答的关键,侧重分析与推断能力的综合考查,题目难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
8.下列物质中,所含化学键类型完全相同的是( )
| A. | CaCl2 K2S | B. | CO2 Na2O2 | C. | NaOH HCl | D. | NH4Cl CaH2 |
9.下列说法中正确的是( )
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
13.常温下下列关系的表述中,正确的是( )
| A. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| B. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 浓度均为0.1 mol/L的三种溶液:①Na2CO3溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
3.下列说法不正确的是( )
| A. | 元素周期表中,除第一和第七周期外,第n周期所含非金属元素的种数均为(8-n) | |
| B. | SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构 | |
| C. | 气态氢化物的水溶液都是酸 | |
| D. | ⅠA族和ⅥA族元素形成的原子个数比1:1、电子总数38的化合物,是有共价键的离子化合物 |
7.元素R的最高价含氧酸分子式为HnRO2n-2,则在R的气态氢化物中,R元素的化合价为( )
| A. | 3n-12 | B. | 3n-6 | C. | 3n-4 | D. | 2n-4 |
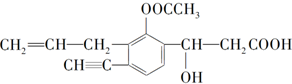 某有机化合物结构简式为
某有机化合物结构简式为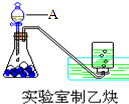 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.