题目内容
3.下列说法不正确的是( )| A. | 元素周期表中,除第一和第七周期外,第n周期所含非金属元素的种数均为(8-n) | |
| B. | SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构 | |
| C. | 气态氢化物的水溶液都是酸 | |
| D. | ⅠA族和ⅥA族元素形成的原子个数比1:1、电子总数38的化合物,是有共价键的离子化合物 |
分析 A、不考虑过渡元素每周期最外层电子数从1递增到8(第一周期除外),当元素最外层电子数小于或等于电子层数,该元素属于金属;当元素最外层电子数大于电子层数,该元素属于金属,据此判断;
B、根据SiCl4、PCl3分子中化学键数目判断;
C、NH3溶液呈碱性;
D、由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,该化合物为Na2O2.
解答 解:A、不考虑过渡元素每周期最外层电子数从1递增到8(第一周期除外),当元素最外层电子数小于或等于电子层数,该元素属于金属;当元素最外层电子数大于电子层数,该元素属于金属,故元素周期表中,除第一和第七周期外,第n周期所含金属元素种数为n,非金属元素(包括稀有气体元素)的种数均为(8-n),故A正确;
B、SiCl4分子中硅原子与氯原子之间形成1对共用电子对,硅原子形成4个Si-Cl键,各原子满足8电子稳定结构,PCl3分子中磷原子与氯原子之间形成1对共用电子对,磷原子形成3个P-Cl键,各原子满足8电子稳定结构,故B正确;
C.NH3溶液呈碱性,并不是所有的气态氢化物的水溶液都是酸,故C错误;
D、由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,该化合物为Na2O2,为离子化合物,含有非极性共价键,故D正确;
故选C.
点评 本题考查元素周期表结构、原子结构与性质关系、化学键及物质推断等,综合性较大,难度中等,注意对基础知识的全面掌握,是对学生综合能力的考查.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
13.已知阴离子X n-含有N个中子,元素X的质量数为A,则a g Xn- 中含电子的物质的量是( )
| A. | $\frac{A-N-n}{aA}$ mol | B. | $\frac{a(A-N)}{A}$ mol | C. | $\frac{m(A-N-n)}{A}$ mol | D. | $\frac{a(A-N+n)}{A}$ mol |
11.下列有关热化学方程式的叙述正确的是( )
| A. | 已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 已知中和热为△H=-57.4 kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
8.下列有关煤和石油的加工方法的叙述中错误的是( )
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油的裂解的目的主要是为了获取不饱和烯烃 |
15.下列物质不可以导电的是( )
| A. | 甲苯 | B. | 金属Cu | C. | NaCl溶液 | D. | HCl溶液 |
13.将充满NO2 和O2混合气体的量筒倒立于水中,充分反应后,保持气体的压强不变,水进入至量筒容积的一半处停止了,则原混合气体中NO2 和O2的体积比( )
| A. | 3:2 | B. | 2:3 | C. | 11:9 | D. | 1:3 |
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为: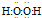 .
.