题目内容
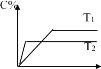
【题目】对于可逆反应mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其它条件不变时C 的百分含量与温度 (T)和压强(P)关系如图所示,下面叙述正确的是( )

A.使用催化剂,C 的百分含量增大
B.升温,化学平衡向正反应方向移动
C.化学方程式的化学计量数关系 n<e+f
D.其他条件不变,增入 A 物质,提高 B 的转化率
【答案】C
【解析】
A. 使用催化剂,降低反应活化能,加快反应速率,平衡不移动,C 的百分含量不变,A错误;
B. 升高温度,反应速率加快,由C 的百分含量与温度 (T)的图可知,T2>T1,且T2时的C 的百分含量小于T1时的C 的百分含量,所以升高温度,化学平衡向逆反应方向移动,B错误;
C. 压强增大,反应速率加快,由C 的百分含量与温度 (P)的图可知,P2>P1,且P2时的C 的百分含量小于P1时的C 的百分含量,所以压强增大,化学平衡向逆反应方向移动,化学方程式的化学计量数关系 n<e+f,C正确;
D. 该反应中,A为固态,增入A物质,平衡不移动,B的转化率不变,D错误;故答案为:C。

【题目】用酸式滴定管准确移取 25.00mL 某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.2000molL﹣1 的氢氧化钠溶液滴定(指示剂为酚酞),滴定结果如下:
NaOH 起始读数 | NaOH 终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.30mL |
第三次 | 0.50mL | 16.30mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为________molL﹣1。
(2)酸式滴定管使用的第一步操作是________
(3)以下操作造成测定结果偏高的原因可能是________。
A.振荡锥形瓶时有液滴溅出
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管

