题目内容
【题目】用酸式滴定管准确移取 25.00mL 某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.2000molL﹣1 的氢氧化钠溶液滴定(指示剂为酚酞),滴定结果如下:
NaOH 起始读数 | NaOH 终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.30mL |
第三次 | 0.50mL | 16.30mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为________molL﹣1。
(2)酸式滴定管使用的第一步操作是________
(3)以下操作造成测定结果偏高的原因可能是________。
A.振荡锥形瓶时有液滴溅出
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
【答案】0.15 检漏 DE
【解析】
(1)由表格可知,第三次滴定误差偏大,不可取,第一次和第二次的平均体积为:18.75mL,![]() ;
;
故答案为:![]() ;
;
(2)保证滴定管完好无损的情况下,第一步要检漏,调节滴定管内液面与滴定管零刻线相切,三分钟后液面无变化,再将玻璃旋塞旋转180°,三分钟后液面仍无变化,说明滴定管不漏;
故答案为:检漏;
(3)A.振荡锥形瓶时有液滴溅出,即待测物n(HCl)减小,需要标准溶液n(NaOH)偏小,而标准溶液c(NaOH)不变,V(NaOH)偏低,依据![]() ,
,![]() 偏低,A错误;
偏低,A错误;
B.滴定终点读数时,俯视滴定管的刻度,导致V(NaOH)偏低,依据![]() ,
,![]() 偏低,B错误;
偏低,B错误;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对结果无影响,C错误;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,导致V(NaOH)偏高,依据![]() ,
,![]() 偏高,D正确;
偏高,D正确;
E.未用标准液润洗碱式滴定管,导致NaOH标准液被稀释,消耗的标准液V(NaOH)偏高,依据![]() ,
,![]() 偏高,E正确;
偏高,E正确;
故答案为:DE。

【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
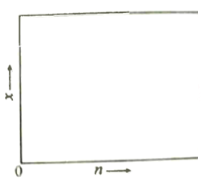
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
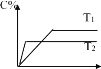
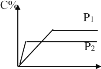
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
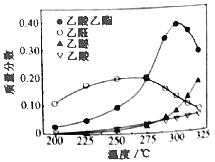
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键