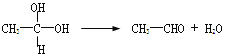
题目内容
【题目】元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
(1)某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为__g/mol.
(2)39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为__mol,金属A的相对原子质量为__.
(3)由NaCl、NaHCO3、Na2CO310H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为___,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)__L.
【答案】56 0.44 108 31.94% 20.16
【解析】
(1)、设出金属的摩尔质量为M,表示出金属的物质的量,然后根据化学方程式中的计量关系来计算;
(2)、根据2HCl~H2来分析消耗盐酸的量;根据该金属的质量等于混合物的质量减去镁的质量,根据摩尔质量M=![]() 来求算;
来求算;
(3)、根据对混合物NaCl、NaHCO3、Na2CO310H2O加热时,NaHCO3分解:2NaHCO3![]() Na2CO3+CO2↑+H2O;Na2CO310H2O
Na2CO3+CO2↑+H2O;Na2CO310H2O![]() Na2CO3+10H2O,故无水CaCl2增重的是水的质量,碱石灰增重的是二氧化碳的质量,据此分析。
Na2CO3+10H2O,故无水CaCl2增重的是水的质量,碱石灰增重的是二氧化碳的质量,据此分析。
(1)、设金属的摩尔质量为M,则12.6g金属的物质的量n=![]() =
=![]() mol,生成氢气5.04L,物质的量n=
mol,生成氢气5.04L,物质的量n=![]() =0.225mol,由于金属为+2价,故1mol金属生成1mol氢气,化学方程式中的计量关系可知:
=0.225mol,由于金属为+2价,故1mol金属生成1mol氢气,化学方程式中的计量关系可知:![]() =0.225解得M=56,故答案为:56;
=0.225解得M=56,故答案为:56;
(2)、由于产生氢气4.928L(S.T.P),故氢气的物质的量n=![]() =
=![]() =0.22mol,而根据在反应中:2HCl~H2,可知消耗盐酸的量为0.44mol;该金属的质量等于混合物的质量减去镁的质量,即m=39.32g﹣12.32g=27g,而摩尔质量M=
=0.22mol,而根据在反应中:2HCl~H2,可知消耗盐酸的量为0.44mol;该金属的质量等于混合物的质量减去镁的质量,即m=39.32g﹣12.32g=27g,而摩尔质量M=![]() =
=![]() =108g/mol,故相对分子质量为108,故答案为:0.44,108;
=108g/mol,故相对分子质量为108,故答案为:0.44,108;
(3)、根据对混合物NaCl、NaHCO3、Na2CO310H2O加热时,NaHCO3分解:2NaHCO3![]() Na2CO3+CO2↑+H2O;Na2CO310H2O
Na2CO3+CO2↑+H2O;Na2CO310H2O![]() Na2CO3+10H2O,故无水CaCl2增重的59.4g是水的质量,物质的量n=
Na2CO3+10H2O,故无水CaCl2增重的59.4g是水的质量,物质的量n=![]() =
=![]() =3.3mol;碱石灰增重的13.2g是二氧化碳的质量,物质的量n=
=3.3mol;碱石灰增重的13.2g是二氧化碳的质量,物质的量n=![]() =0.3mol,根据NaHCO3分解反应可知:2NaHCO3
=0.3mol,根据NaHCO3分解反应可知:2NaHCO3![]() Na2CO3+CO2↑+H2O,NaHCO3的物质的量为0.6mol,质量为50.4g,故在混合物中的质量分数=
Na2CO3+CO2↑+H2O,NaHCO3的物质的量为0.6mol,质量为50.4g,故在混合物中的质量分数=![]() ×100%=31.94%;
×100%=31.94%;
NaHCO3的物质的量为0.6mol,分解时生成的水为0.3mol,而水的物质的量共为3.3mol,故由Na2CO310H2O分解生成的水的物质的量为3mol,根据
Na2CO310H2O![]() Na2CO3+10H2O可知,Na2CO310H2O的物质的量为0.3mol,与盐酸反应时,生成二氧化碳的物质的量为n=0.6mol+0.3mol=0.9mol,
Na2CO3+10H2O可知,Na2CO310H2O的物质的量为0.3mol,与盐酸反应时,生成二氧化碳的物质的量为n=0.6mol+0.3mol=0.9mol,
在标况下的体积V=nVm=0.9mol×22.4L/mol=20.16L,故答案为:31.94%; 20.16L。

 阅读快车系列答案
阅读快车系列答案