题目内容
【题目】舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
【答案】B C A C
【解析】
(1)从反应物和生成物的种类的多少,反应物和生成物的物质的类别分析;
(2)从化合价的变化分析;
(3)从化学反应速率的影响因素分析;
(4)反应放热,从化学键的角度分析;
(1)氯气和氢气在光照的条件下反应生成氯化氢,是两种物质生成一种物质的反应,属于化合反应,答案选B;
(2) A.Mn元素化合价降低被还原,MnO2为氧化剂,故A错误;
B.MnCl2还原产物,而不是氧化产物,故B错误;
C.Cl2是氧化产物,故C正确;
D.H2O既不是氧化产物,也不是还原产物,故D错误;
答案选C。
(3)A.增大盐酸的浓度能加快反应速率,故A正确;
B.稀盐酸与二氧化锰不反应,故B 错误;
C.升高温度能加快反应速率,故C错误;
D.MnO2为固体,增大MnO2的质量反应速率无明显变化,故D错误;
答案选A。
(4)A.断开化学键吸热,故A错误;
B.形成化学键放热,故B错误;
C.燃烧都是放热反应,故C正确;
D.反应物的总能量小于生成物的总能量为吸热反应,故D错误;
答案选C。

【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
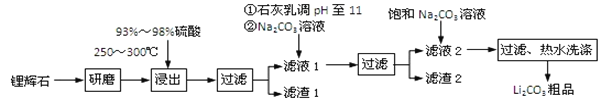
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
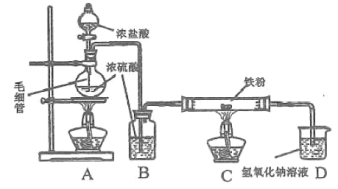
【题目】在实验室中,用下图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是
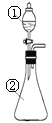
选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
A. | 氢氧化钠 | 明矾溶液 | 开始时即产生白色沉淀 |
B. | 浓硫酸 | 铜片 | 产生无色气体,溶液变蓝 |
C. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
D. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 开始时无明显现象 |
A.AB.BC.CD.D