题目内容
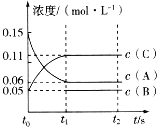
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
【答案】B
【解析】
A.加入催化剂,可以加快化学反应速率,但不能使平衡发生移动,因此不能改变NO的转化率,A错误;
B.充入CO增大压强,反应物的浓度增大,化学反应速率加快,增大压强,化学平衡向气体体积减小的正反应方向移动,NO的转化率增大,B正确;
C.氮气是生成物,充入N2,平衡逆向移动,NO的转化率降低,C错误;
D.升高温度化学平衡向吸热的逆反应方向移动,NO的转化率降低,D错误;
故合理选项是B。

 阅读快车系列答案
阅读快车系列答案【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。
【题目】下表是元素周期表的一部分,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ⑩ | ② | |||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
四 | ⑧ | ⑨ |
(1)在这些元素中,最活泼的非金属元素是___(元素符号),原子最外层达到稳定结构的元素是__(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是____(填化学式);
(3)写出④的氧化物与③的最高价氧化物对应的水化物相互反应的化学方程式_____;
(4)③、⑥、⑧的原子半径由大到小为__﹥___﹥__/span>(填元素符号)①、⑤的最高价含氧酸酸性__﹥__(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式________;
(6)写出实验室制备⑩的氢化物的化学方程式_________。
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.