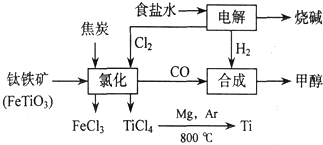
题目内容
15.下列电离方程式中,正确的是( )| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
分析 A、硫酸铝电离生成铝离子和硫酸根离子,铝离子和硫酸根离子离子符号书写错误;
B、硫酸钾电离生成钾离子和硫酸根离子,硫酸根离子原子团不能拆写;
C、氯化铜电离生成铜离子和氯离子,该电离方程式质量守恒和电荷守恒;
D、碳酸钠电离生成钠离子和碳酸根离子,电离方程式左右电荷不守恒.
解答 解:A、硫酸铝电离的方程式为:Al2(SO4)3=2Al3++3SO42-,故A错误;
B、硫酸钾电离生成钾离子和硫酸根离子,电离的方程式为:K2SO4=2K++SO42-,故B错误;
C、氯化铜电离的方程式为:CuCl2=Cu2++2Cl-,故C正确;
D、碳酸钠电离时电离出钠离子和碳酸根离子,电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选C.
点评 本题考查了电离方程式的书写,书写电离方程式时,要遵循质量守恒定律和电荷守恒定律,同时要注意离子的正确书写、离子团不能拆开,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
17.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:1molH2(g)与足量氮气完全反应生成NH3(g)的反应热△H(KJ/mol)为( )
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
3.对实验甲~丁的实验现象预测正确的是( )
| A. | 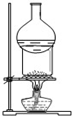 用于I2与NH4Cl混合物的分离 | B. |  可用于制取及观察Fe(OH)2 | ||
| C. | 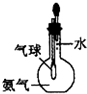 验证氨气易溶于水 | D. | 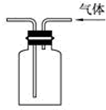 可用于排空气法收集CO2气体 |
20.下列无色溶液中,各组离子能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |
7.下列物质性质与应用对应关系正确的是( )
| A. | 氯化镁属于电解质,工业上可用电解其溶液的方法制镁 | |
| B. | 钠钾合金的硬度小,可用作快中子反应堆的热交换剂 | |
| C. | Fe2O3是红棕色固体,可以制成红色的油漆、涂料 | |
| D. | 溴单质在CCl4中的溶解度大,可用CCl4萃取Br- |
4.下列事实、离子方程式及其对应关系均正确的是( )
| A. | 向Ag2S浊液中滴加少量稀NaCl溶液,黑色沉淀逐渐变成白色:Ag2S+Cl-?AgCl+S2- | |
| B. | 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O | |
| D. | 向水杨酸(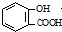 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: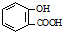 +2HCO3-→ +2HCO3-→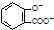 +2CO2↑+2H2O +2CO2↑+2H2O |
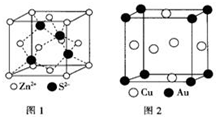 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题: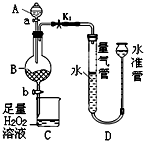 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).