题目内容
6.下列有关说法正确的是( )| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |
分析 A.锥形瓶无需干燥;
B.加水稀释促进一水合氨电离,加入氯化铵固体抑制一水合氨电离;
C.NaAlO2溶液加热生成氢氧化铝和氢氧化钠,最终仍生成NaAlO2;
D.一水合氨为弱电解质,电离吸热.
解答 解:A.锥形瓶无论是否干燥,对实验结果都没有影响,故A错误;
B.加水稀释促进一水合氨电离,一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(OH-)减小,加入氯化铵固体抑制一水合氨电离,一水合氨电离向逆反应方向移动,导致溶液中c(OH-)减小,c(H+)增大,故B正确;
C.NaAlO2溶液加热生成氢氧化铝和氢氧化钠,最终仍生成NaAlO2,故C正确;
D.一水合氨为弱电解质,电离吸热,则100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量小于0.573 kJ,故D错误.
故选BC.
点评 本题考查较为综合,涉及中和滴定、弱电解质的电离、盐类的水解等问题,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意盐类水解的原理,特别是能把握相关物质的性质.

练习册系列答案
相关题目
17.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:1molH2(g)与足量氮气完全反应生成NH3(g)的反应热△H(KJ/mol)为( )
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
14.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同.25℃时,0.1mol/L X和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y、Z、W三种元素组成化合物的水溶液可能显碱性 | |
| B. | Z与Y、Z与W形成的化合物的化学键类型完全相同 | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
1.用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1mol碱式碳酸铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH.下列有关叙述不正确的是( )
| A. | 电解过程产生的气体体积(在标准状况下)为5.6 L | |
| B. | 电解过程只发生了2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 | |
| C. | 电解过程转移的电子数为3.612×1023个 | |
| D. | 加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
3.对实验甲~丁的实验现象预测正确的是( )
| A. | 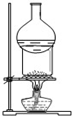 用于I2与NH4Cl混合物的分离 | B. |  可用于制取及观察Fe(OH)2 | ||
| C. | 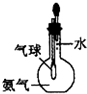 验证氨气易溶于水 | D. | 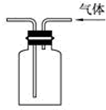 可用于排空气法收集CO2气体 |
4.下列事实、离子方程式及其对应关系均正确的是( )
| A. | 向Ag2S浊液中滴加少量稀NaCl溶液,黑色沉淀逐渐变成白色:Ag2S+Cl-?AgCl+S2- | |
| B. | 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O | |
| D. | 向水杨酸(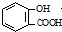 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: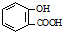 +2HCO3-→ +2HCO3-→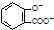 +2CO2↑+2H2O +2CO2↑+2H2O |
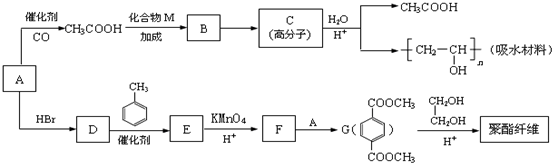
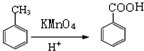
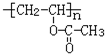 ,M的结构简式是HC≡CH,
,M的结构简式是HC≡CH,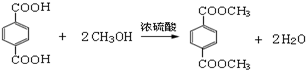 .
.
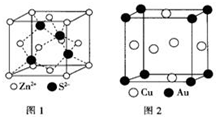 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题: