题目内容
2.短周期元素形成的离子X2-与Y+都与Ne原子具有相同的电子层结构,则下列叙述中正确的是( )| A. | 原子序数X>Y | B. | 原子半径X<Y | ||
| C. | X和Y一定同周期 | D. | X是第ⅡA族元素,Y是第VⅡA族元素 |
分析 短周期元素形成的离子X2-与Y+都与Ne原子具有相同的电子层结构,则X为O元素、Y为Na元素,据此解答.
解答 解:短周期元素形成的离子X2-与Y+都与Ne原子具有相同的电子层结构,则X为O元素、Y为Na元素.
A.原子序数X(O)<Y(Na),故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:X(O)<Y(Na),故B正确;
C.X处于第二周期,Y处于第三周期,故C错误;
D.X处于ⅥA族,Y处于IA族,故D错误,
故选B.
点评 本题考查原子结构与元素周期律,比较基础,注意对元素周期律的理解掌握,有利于基础知识的巩固.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
7.下列关于溶液中离子浓度关系正确的是( )
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| B. | NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,混合溶液中:c(Na+)<c(CH3COO-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+) |
17.下列各组粒子不属于等电子体的是( )
| A. | O3和NO2 | B. | CH4和NH4+ | C. | N2O和CO2 | D. | PCl3和SO32- |
14.下列物中含有共价键的离子化合物是( )
| A. | HF | B. | Na2O2 | C. | CaCl2 | D. | H2SO4 |
11.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
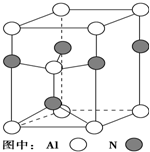 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示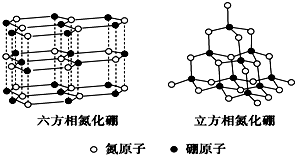
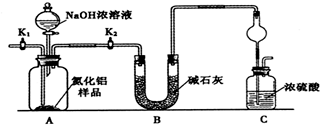
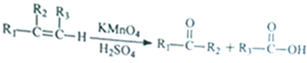 由
由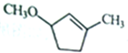 到
到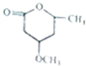 的合成路线如下所示:
的合成路线如下所示: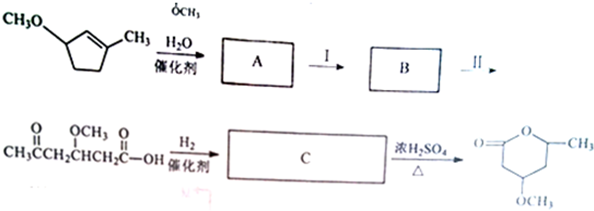
 ;B
;B ;C
;C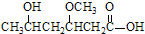 .
.