题目内容
8.标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:①c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
分析 标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中恰好完全反应生成碳酸钠,根据碳酸钠溶液中碳酸根离子水解判断离子浓度大小;
①溶液中遵循质子守恒,根据碳酸氢钠溶液中的质子守恒书写;
②根据碳酸钠溶液中的电荷守恒解答.
解答 解:标准状况下,1.12L CO2的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,氢氧化钠的物质的量为:1mol•L-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,
①根据碳酸钠溶液中的质子守恒可得:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),
故答案为:c(HCO3-)+c(H+);
②根据碳酸钠溶液中的电荷守恒可知:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:2c(CO32-)+c(HCO3-)+c(OH-).
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中应用方法.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
18.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法错误的是( )
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
19.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:(注:亚硝酸:中强酸,既具有氧化性又具有还原性,不很稳定,在水溶液中易发生岐化反应.)

根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A. | 溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2、K2CO3 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 气体A和气体D一定均为纯净物 | |
| D. | 原混合物中一定含有MnO2、Fe2O3 |
3.现有7瓶失去了标签的液体,已知它们是有机溶剂,可能是①乙醇②乙酸 ③苯④乙酸乙酯 ⑤油脂⑥葡萄糖⑦蔗糖溶液,现通过如下实验步骤来确定试剂中所装的液体名称.
(1)试给它们的试剂瓶重新贴上标签:
A乙醇、B乙酸、C苯、D乙酸乙酯、E油脂、F葡萄糖溶液、G蔗糖溶液;
(2)写出在D中加入NaOH溶液并加热的化学方程式.CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH
(3)已知乙醛发生银镜反应的化学方程式为:
CH3CHO+4[Ag(NH3)2]OH $\stackrel{△}{→}$ (NH4)2CO3+4Ag↓+6NH3↑+2H2O.
试写出葡萄糖发生银镜反应的化学方程式为CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{△}{→}$H2O+2Ag↓+3NH3+CH2OH(CHOH)4COONH4.
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
| 分别取少量7种液体于试管中加新制的Cu(OH)2并加热 | 只有B使沉淀溶解,F中产生红色沉淀 |
| 各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
A乙醇、B乙酸、C苯、D乙酸乙酯、E油脂、F葡萄糖溶液、G蔗糖溶液;
(2)写出在D中加入NaOH溶液并加热的化学方程式.CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH
(3)已知乙醛发生银镜反应的化学方程式为:
CH3CHO+4[Ag(NH3)2]OH $\stackrel{△}{→}$ (NH4)2CO3+4Ag↓+6NH3↑+2H2O.
试写出葡萄糖发生银镜反应的化学方程式为CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{△}{→}$H2O+2Ag↓+3NH3+CH2OH(CHOH)4COONH4.
2.短周期元素形成的离子X2-与Y+都与Ne原子具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数X>Y | B. | 原子半径X<Y | ||
| C. | X和Y一定同周期 | D. | X是第ⅡA族元素,Y是第VⅡA族元素 |
3.A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )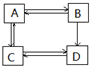

| A. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | C→A的反应类型为加成反应 |