题目内容
14.下列物中含有共价键的离子化合物是( )| A. | HF | B. | Na2O2 | C. | CaCl2 | D. | H2SO4 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属族、碱土金属族元素和氧族、卤族元素之间易形成离子键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,据此分析解答.
解答 解:A.HF中H-F原子之间只存在共价键,为共价化合物,故A错误;
B.过氧化钠中钠离子和过氧根离子之间存在离子键、过氧根离子之间O-O原子之间存在共价键,为离子化合物,故B正确;
C.氯化钙中钙离子和氯离子之间只存在离子键,不含共价键,故C错误;
D.硫酸分子中S-O、O-H原子之间只存在共价键,为共价化合物,故D错误;
故选B.
点评 本题考查离子键和共价键判断,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,注意不能根据是否含有金属元素判断离子键,易错选项是C.

练习册系列答案
相关题目
19.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:(注:亚硝酸:中强酸,既具有氧化性又具有还原性,不很稳定,在水溶液中易发生岐化反应.)

根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A. | 溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2、K2CO3 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 气体A和气体D一定均为纯净物 | |
| D. | 原混合物中一定含有MnO2、Fe2O3 |
2.短周期元素形成的离子X2-与Y+都与Ne原子具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数X>Y | B. | 原子半径X<Y | ||
| C. | X和Y一定同周期 | D. | X是第ⅡA族元素,Y是第VⅡA族元素 |
19.某课题组通过实验探究外界条件变化对化学反应速率产生的影响.
【实验设计】以2NO+2CO2C02+N2为研究对象,
【图象分析与结论】测定了三组实验中CO浓度随时间变化的曲线图如图:
请回答下列问题
(1)完成【实验设计】(表中不要留空格)
(2)计算第Ⅱ族实验中,反应达平衡时NO的浓度为2.50×10-3mol/L
(3)实验结论:由曲线Ⅰ、Ⅱ可知:增大催化剂比表面积,该反应速率加快,由曲线Ⅰ、Ⅲ可知,升高温度,加快反应速率
(4)升高温度,该反应中NO的转化率减小(填“增大”、“减小”或“无影响”)
【实验设计】以2NO+2CO2C02+N2为研究对象,
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 4.00×10-3 | 120 | ||
| Ⅲ | 探究温度对反应速率的影响 | 360 | 80 |

请回答下列问题
(1)完成【实验设计】(表中不要留空格)
(2)计算第Ⅱ族实验中,反应达平衡时NO的浓度为2.50×10-3mol/L
(3)实验结论:由曲线Ⅰ、Ⅱ可知:增大催化剂比表面积,该反应速率加快,由曲线Ⅰ、Ⅲ可知,升高温度,加快反应速率
(4)升高温度,该反应中NO的转化率减小(填“增大”、“减小”或“无影响”)
6.已知分子式为C10H14的有机物,该有机物不能与溴水发生加成反应,分子中只有一个烷基,此烷基的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
3.A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )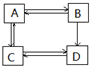

| A. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | C→A的反应类型为加成反应 |

 ;
;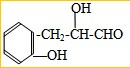 或
或 .
.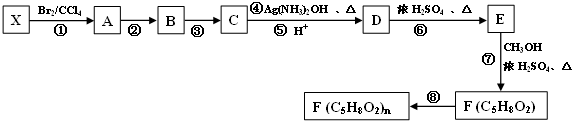
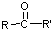 ,
,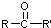 不易被氧化成羧酸
不易被氧化成羧酸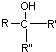 不易被氧化成醛或酮
不易被氧化成醛或酮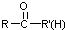
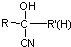
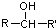
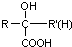 (R、R′、R″均代表烃基 )
(R、R′、R″均代表烃基 )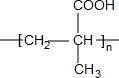 ;
; ;
;