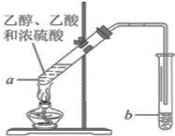
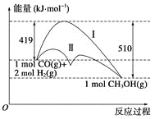
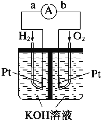
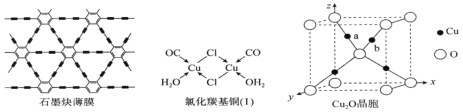
题目内容
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
【答案】D
【解析】
A. 甲容器中平衡时,消耗的CO的物质的量为1.2mol-0.8mol=0.4mol,根据反应CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol,可知平衡时放出热量为:41 kJ/mol×0.4mol=16.4 kJ,故A正确;
CO2(g) + H2(g) H = -41 kJ/mol,可知平衡时放出热量为:41 kJ/mol×0.4mol=16.4 kJ,故A正确;
B. CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
起始(mol) 1.2 0.6 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡(mol) 0.8 0.2 0.4 0.4
在T1达到平衡状态时甲容器中,c(CO)=0.4mol/L,c(H2O)=0.1mol/L,c(CO2)=0.2mol/L,c(H2)= 0.2mol/L,则该温度下反应的平衡常数K甲 = 0.2×0.2/0.4×0.1=1,故B正确;
C. CO(g) + H2O(g) ![]() CO2(g) + H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则0.8/1.2=a/2.4,解得a=1.6,故C正确;
CO2(g) + H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则0.8/1.2=a/2.4,解得a=1.6,故C正确;
D.根据C项可知a=1.6,乙容器中,平衡时CO的转化率为![]() ×100%≈33%,故D错误;
×100%≈33%,故D错误;
故选D。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案