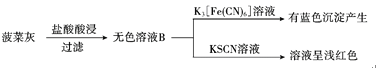
题目内容
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) ![]() CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
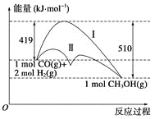
A.生成1mol CH3OH(g)时,该反应吸收的热量为91 kJ。
B.加入催化剂可以减少反应最终放出的热量
C.1mol CO(g)与2molH2(g)的总能量大于1mol CH3OH(g)的总能量
D.如果该反应生成CH3OH (l),则放出的能量会减少
【答案】C
【解析】
催化剂可以降低反应活化能,所以曲线I为不使用催化剂的能量变化,曲线II为使用催化剂的能量变化。
A.该反应的反应物能量高于生成物能量,为放热反应,根据图中数据可知,生成1mol CH3OH(g)时,该反应释放的能量为91 kJ,故A错误;
B.催化剂只改变活化能,不影响反应的热效应,故B错误;
C.据图可知,反应物的能量高于生成物,即1mol CO(g)与2molH2(g)的总能量大于1mol CH3OH(g)的总能量,故C正确;
D.CH3OH由气态变为液体需要放出能量,所以如果生成CH3OH (l),则放出的能量会增多,故D错误;
故答案为C。

【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%