��Ŀ����
����Ŀ��ijͬѧΪ��ȡ�������������Թ�a�м���3ml�Ҵ���Ȼ������Թܱ���������2mlŨ�����2ml���ᣬ����ͼ��ʾ���Ӻ�װ�ý���ʵ�顣��ش�
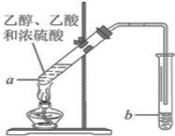
(1)�Թ�b��ʢ�ŵ���Һ��_________________��
(2)ʵ����ɺ��Թ�b��ҳ���������IJ�����ˮ����״Һ��������������Һ��������Ҫ�õ��IJ���������______��
(3)�Ҵ������ᷴӦ�������������ķ�Ӧ������___________��
(4)����ȡ���������У��й�Ũ���������˵���������_______________��
A.���� B.��ˮ�� C.��ˮ�� D.��߷�Ӧ����
(5)�Թ�b����Һ��������_______________��
(6)������������Ӧ�жϼ���ʽ����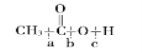 ��__________����
��__________����
���𰸡�Na2CO3 ��Һ©�� ȡ����Ӧ C �����Ҵ����к����ᡢ��������������ˮ�е��ܽ�� b
��������
(1)�Ʊ���������ʱ���ñ���̼������Һ��������������
(2)����b�е�Һ������ֲ㣬�÷�Һ�����룻
(3)������Ҵ���Ũ���������·���������Ӧ����������������ˮ��
(4)�������Ҵ���Ũ�������������÷�ӦΪ���淴Ӧ��Ũ������ˮ����ƽ���������������������ƶ���
(5)�������������ڱ���̼���ƣ��Ҵ���ˮ���ܣ������ܱ�̼�������գ�
(6)����������Ӧʱ�������ǻ�����������
(1)�Ʊ���������ʱ���ñ���̼������Һ�������������������Թ�b��ʢ�ŵ��DZ���̼������Һ��
(2)b�е�Һ������ֲ㣬�÷�Һ�����룬��Ҫ�õ��IJ��������Ƿ�Һ©����
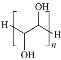
(3)������Ҵ���Ũ���������·���������Ӧ����������������ˮ����Ӧ����ʽ��CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O����Ӧ������ȡ����Ӧ(������Ӧ)��
CH3COOC2H5+H2O����Ӧ������ȡ����Ӧ(������Ӧ)��
(4)�������Ҵ�����������Ӧ��Ũ�������������ӿ췴Ӧ���ʣ��÷�ӦΪ���淴Ӧ��Ũ������ˮ����ƽ���������������������ƶ�����Ũ���������Ϊ��������߷�Ӧ���ʣ���ˮ����ѡC��
(5)�Ʊ���������ʱ���ñ���̼������Һ����������������Ҫ���������������������ڱ���̼���ƣ��Ҵ���ˮ���ܣ������ܱ�̼�������գ����Ա���̼������Һ�������������Ҵ����к����ᡢ��������������ˮ�е��ܽ�ȣ�
(6)�л���ʹ���Ӧ������ʱ�������ǻ������⣬���жϵ���C��O������ѡb��

����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��____________��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��__________��
��3������Һ����SO2�Ĺ����У�pH��n(SO32-)��n(HSO3-)�仯��ϵ���±���
n(SO32-)��n(HSO3-) | 91��9 | 1��1 | 9��91 |
pH | 8.2 | 7.2 | 6.2 |
�����ϱ��жϣ�NaHSO3��Һ��____�ԣ��û�ѧƽ��ԭ�����ͣ�_____��
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ)��___��
a��c(Na��)��2c(SO32-)��c(HSO3-)
b��c(Na��)��c(HSO3-)��c(SO32-)��c(H��)��c(OH��)
c��c(Na��)��c(H��)��c(SO32-)��c(HSO3-)��c(OH��)
��4����֤��Na2SO3��Һ�д���SO32-��H2O![]() HSO3-��OH��ˮ��ƽ�����ʵ��____(�����)��
HSO3-��OH��ˮ��ƽ�����ʵ��____(�����)��
A�������̪��Һ��죬�ټ���H2SO4��Һ���ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ
����Ŀ���¶�ΪT1ʱ�����ݻ�Ϊ2 L ���ܱ������ס����зֱ����һ������CO(g)��H2O(g)��������Ӧ��CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = ��41 kJ/mol���������£�����˵������ȷ����
CO2(g) + H2(g) H = ��41 kJ/mol���������£�����˵������ȷ����
���� | �� | �� | ||
��Ӧ�� | CO | H2O | CO | H2O |
��ʼʱ���ʵ�����mol�� | 1.2 | 0.6 | 2.4 | 1.2 |
ƽ��ʱ���ʵ�����mol�� | 0.8 | 0.2 | a | b |
A. �������У�ƽ��ʱ����Ӧ�ų�������Ϊ16.4 kJ
B. T1ʱ����Ӧ��ƽ�ⳣ��K�� = 1
C. ƽ��ʱ������CO��Ũ���Ǽ��е�2��
D. �������У�ƽ��ʱCO��ת����ԼΪ75%