题目内容
15.下列物质中,含有极性共价键的离子化合物是( )| A. | H2SO4 | B. | 氧化钠 | C. | 氯化钠 | D. | 氢氧化钠 |
分析 活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,据此分析解答.
解答 解:A.硫酸分子中S-O原子、O-H原子之间只存在极性键,为共价化合物,故A错误;
B.氧化钠中钠离子和氧离子之间只存在离子键,为离子化合物,故B错误;
C.氯化钠中钠离子和氯离子之间只存在离子键,为离子化合物,故C错误;
D.氢氧化钠中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物,故D正确;
故选D.
点评 本题考查化学键和化合物类型之间关系,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.常温下,下列物质投(通)入水中,最终所得溶液中水电离的c(H+)>10-7mol•L-1的是( )
| A. | NaOH | B. | Na2SO4 | C. | HCl | D. | NH4Cl |
6.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| C. | 聚合物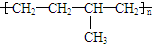 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| D. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量相等 |
3.咖啡鞣酸具有较广泛的抗菌作用,结构简式如图所示.下列关于咖啡鞣酸的说法中不正确的是( )

| A. | 分子式为C16H18O9 | |
| B. | 在一定条件下能发生消去反应 | |
| C. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
10.下列叙述正确的是( )
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 酸性:HClO4>H2SO4>H3PO4 |
7.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列说法正确的是( )
| A. | 铅蓄电池是新型的绿色环保电池 | |
| B. | 当电路中转移0.2mol电子时,消耗的H2SO4为0.2 mol | |
| C. | 铅蓄电池放电时负极质量减小,正极质量增加 | |
| D. | 铅蓄电池放电时电子由负极经过溶液定向移动到正极 |
4.已知维生素A1的结构简式为: ,关于它的叙述正确的是( )
,关于它的叙述正确的是( )
 ,关于它的叙述正确的是( )
,关于它的叙述正确的是( )| A. | 维生素A1是一种易溶于水的醇 | |
| B. | 维生素A1分子中含有苯环结构 | |
| C. | 维生素A1能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,且原理相同 | |
| D. | 1mol维生素A1在催化剂作用下,最多与5molH2发生加成反应 |