题目内容
5.常温下,下列物质投(通)入水中,最终所得溶液中水电离的c(H+)>10-7mol•L-1的是( )| A. | NaOH | B. | Na2SO4 | C. | HCl | D. | NH4Cl |
分析 常温下,下列物质投(通)入水中,最终所得溶液中水电离的c(H+)>10-7mol•L-1,说明加入该溶质促进水电离,则该物质是含有弱离子的盐,据此分析解答.
解答 解:酸或碱抑制水电离,含有弱离子的盐促进水电离,常温下,下列物质投(通)入水中,最终所得溶液中水电离的c(H+)>10-7mol•L-1,说明加入该溶质促进水电离,则该物质是含有弱离子的盐,
A.NaOH是强碱,抑制水电离,故A错误;
B.硫酸钠是强酸强碱盐,不影响水的电离,故B错误;
C.盐酸是酸,抑制水电离,故C错误;
D.氯化铵是强酸弱碱盐,铵根离子水解促进水电离,故D正确;
故选D.
点评 本题以盐类水解为载体考查水的电离,明确水电离影响因素是解本题关键,温度、酸、碱和含有弱离子的盐影响水电离,题目难度不大.

练习册系列答案
相关题目
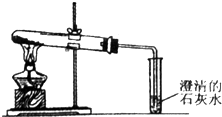
16.某课外小组设计的实验室制取乙酸乙酯的装置如图所示.已知:
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关物质的沸点如下表所示:
请回答:
(1)若用同位素18O表示反应产物是分子中的氧原子,请写出反应的化学方程式(标明18O在反应物中的位置):CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)分液漏斗A中应加入的试剂为浓硫酸,圆底烧瓶B中应加入少量碎瓷片,目的为防止暴沸.
(3)球形干燥管C的作用为防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(4)从D中分离出乙酸乙酯的操作名称为分液;这样得到乙酸乙酯中常含有一定量的乙醇、乙醚和水,欲得到较纯净的乙酸乙酯,应先加入无水氯化钙,目的是分离出乙醇和水;最后进行蒸馏,收集77℃左右的馏分,得到比较纯净的乙酸乙醇.
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH②有关物质的沸点如下表所示:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)若用同位素18O表示反应产物是分子中的氧原子,请写出反应的化学方程式(标明18O在反应物中的位置):CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)分液漏斗A中应加入的试剂为浓硫酸,圆底烧瓶B中应加入少量碎瓷片,目的为防止暴沸.
(3)球形干燥管C的作用为防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(4)从D中分离出乙酸乙酯的操作名称为分液;这样得到乙酸乙酯中常含有一定量的乙醇、乙醚和水,欲得到较纯净的乙酸乙酯,应先加入无水氯化钙,目的是分离出乙醇和水;最后进行蒸馏,收集77℃左右的馏分,得到比较纯净的乙酸乙醇.
13.下列有关化学用语正确的是( )
| A. | N2的电子式:N??N | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe3++SO${\;}_{4}^{2-}$ |
10.常温常压下,下列化合物以气态形式存在的是( )
| A. | 苯 | B. | 苯酚 | C. | 乙酸 | D. | 甲醛 |
17.下列各组金属的冶炼最适合用H2或CO把它从化合物中还原出来的是( )
| A. | Ca、Mg | B. | Al、Fe | C. | Hg、Ag | D. | Fe、Cu |
15.下列物质中,含有极性共价键的离子化合物是( )
| A. | H2SO4 | B. | 氧化钠 | C. | 氯化钠 | D. | 氢氧化钠 |