题目内容
16.工业上冶炼冰铜(mCu2O•nFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1).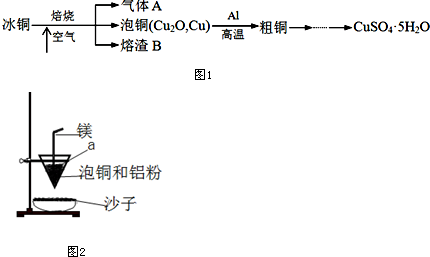
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的cd(填序号)吸收.
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$6Cu+Al2O3.
②装置中镁带的作用是燃烧放出大量的热,创造高温环境(或引燃剂).泡铜和铝粉混合物表面覆盖少量白色固体a,a是氯酸钾(或KClO3).
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数.(不考虑H2S的自身分解)0.6或0.7(写出必要的计算过程,否则不得分).
已知:氧气不足时:2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O 氧气足量时:2H2S+3O2═$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
分析 (1)气体A为SO2,可用碱液吸收;
(2)①Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应;
②镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧;
(3)发生2H2S+O2=2S+2H2O(a),2H2S+3O2=2SO2+2H2O(b),结合反应的方程式以及体积的变化利用差量法计算.
解答 解:(1)气体A为SO2,可用碱液吸收,则应用NaOH或氨水,故答案为:c d;
(2)①3Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$6Cu+Al2O3,
故答案为:3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$6Cu+Al2O3;
②镁带起到引燃作用,燃烧放出大量的热,创造高温环境,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧,
故答案为:燃烧放出大量的热,创造高温环境(或引燃剂);氯酸钾(或KClO3);
(3)2H2S+O2=2S+2H2O(a) 2H2S+3O2=2SO2+2H2O(b),
方法一
由反应知,当H2S:O2>2:1时,按(a)进行,气体体积可能减少30%,
当2:1>H2S:O2>2:3时既有反应(a)又有反应(b),气体体积可能减少30%,
设原混合气体中H2S、O2分别为x、yL,
Ⅰ2H2S+O2=2S+2H2O 气体体积减少,
2y y 2y y
∴$\frac{v}{x+y}$=0.3 $\frac{x}{y}$=$\frac{7}{3}$
∴$\frac{7}{7+3}$=0.7,
ⅡxH2S+yO2=(y-$\frac{x}{2}$)SO2+(1.5x-y)S+xH2O 气体体积减少
x y (y-$\frac{x}{2}$) $\frac{x}{2}$
∴$\frac{0.5x}{x+y}$=0.3 $\frac{x}{y}$=$\frac{3}{2}$
∴$\frac{3}{2+3}$=0.6
方法二
反应(b)可看作在反应(a)后发生反应S+O2=SO2,此反应没有气体体积改变,气体体积的减少由反应(a)引起的,
设原混合气体为100L,
2H2S+O2=2S+2H2O 气体体积减少,
60 30 100×30%=30
剩余气体为100-60-30=10L,
若 10L为H2S,∴$\frac{60+10}{100}$/100=0.7,
若 10L为O2,∴$\frac{60}{100}$=0.6,
故答案为:0.6或0.7.
点评 本题综合考查制备实验的涉及以及物质的分离提纯知识,侧重于综合考查学生的实验能力和数据分析能力,注意把握实验原理和实验方法,本题难点为混合物的计算,注意把握反应的化学方程式,利用差量法计算,题目难度中等.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 酒精、冰醋酸分别属于电解质、弱电解质 | |
| B. | 冶炼金属钠、铁,工业常用的方法分别是电解法、热分解法 | |
| C. | 铝热反应、实验室制氢气都属于置换反应 | |
| D. | 冰醋酸、碱式碳酸铜分别属于:酸、碱 |
| A. | Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂 | |
| B. | KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原 | |
| C. | 凡是氧化还原反应都能造福人类 | |
| D. | 在反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中H2O是还原剂 |
| A. | 分子内共价键越强,分子越稳定,其熔、沸点也越高 | |
| B. | 共价化合物溶于水,分子内共价键一定被破坏 | |
| C. | 离子键的形成一定有电子的得与失 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
| A. | 0.1 mol•L-1 | B. | 1 mol•L-1 | C. | 3 mol•L-1 | D. | 1.5 mol•L-1 |