题目内容
5.实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:(1)下列操作中,容量瓶具备的功能有A
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(2)根据计算用托盘天平称取NaOH的质量为2.0g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于0.1mol/L(填“大于”、“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度小于0.1mol/L.
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6mL(计算结果保留一位小数).
分析 (1)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(2)依据配制溶液体积选择合适容量瓶,依据m=CVM计算需要氢氧化钠的质量;根据公式c=$\frac{n}{V}$,可以根据影响n和V的因素来进行误差分析;
(3)依据C=$\frac{1000ρω}{M}$计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积.
解答 解:(1)容量瓶作为精密仪器不可用于储存和加热溶解固体、稀释液体,也不能测量除其规格以外容积的液体体积,
故答案为:A;
(2)需要0.1mol/L NaOH溶液450mL,应选择500mL容量瓶,配制500mL溶液,需要氢氧化钠的质量=0.1mol/L×40g/mol×0.5L=2.0g;
定容时仰视刻度线,导致溶液体积V偏大,溶液浓度偏小,溶液浓度小于0.1mol/L;
若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量偏小,溶液浓度偏小,溶液浓度小于0.1mol/L;
故答案为:2.0 g;小于;小于;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×18.4mol/L=0.5mol/L×0.5L
解得V=0.0136L,即13.6mL;
故答案为:13.6.
点评 本题考查一定物质的量浓度溶液的稀释,明确配制原理是解题关键,注意容量瓶规格的选择和使用注意事项,题目难度不大.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
13.有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是( )
| A. | 若B(OH)m 是强碱,则A(OH)m一定为强碱 | |
| B. | 若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 | |
| C. | 若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属 | |
| D. | 若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性 |
20.下列叙述正确的是( )
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 两种原子若核外电子排布相同,则一定属于同种元素 |
10.下列解释物质用途或现象的反应方程式不准确的是( )
| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+=Cl2↑+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
17.下列离子组在给定条件下,离子共存判断及反应的离子方程式均正确的是( )
| 选项 | 条 件 | 离子组 | 离子共存判断及离子方程式 |
| A | 常温下,由水电离出的C(H+)为1×10-12 mol•L-1 | K+、Cl-、S2-SO32- | 一定能大量共存 |
| B | 滴加氨水 | Na+、Fe3+、Cl- | 不能大量共存 Fe3++3OH-═Fe(OH)3↓ |
| C | p=1的溶液 | Fe3+、I- Cl- | 不能大量共存 2Fe3++2I-═2Fe2++I2 |
| D | 通入少量SO2气体 | K+、Na+、ClO- | 不能大量共存 2ClO-+SO2+H2O═2HClO+SO32- |
| A. | A | B. | B | C. | C | D. | D |
14.某烃的分子量为84,可使酸性高锰酸钾溶液褪色,该烃的链状且主链上有4个碳原子的同分异构体的数目是( )(不考虑顺反异构)
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
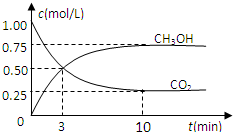 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
 常温下,体积相同pH相同的盐酸和醋酸,同时加入足量表面积相同的锌粒,反应刚开始时反应速率盐酸等于醋酸,反应开始后,反应速率盐酸小于醋酸,反应结束时,产生氢气盐酸小于醋酸.(填大于、小于或等于)
常温下,体积相同pH相同的盐酸和醋酸,同时加入足量表面积相同的锌粒,反应刚开始时反应速率盐酸等于醋酸,反应开始后,反应速率盐酸小于醋酸,反应结束时,产生氢气盐酸小于醋酸.(填大于、小于或等于)