题目内容
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)  cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
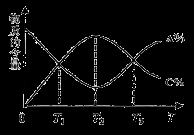
A.该反应在T1、T3温度时达到过化学平衡 B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应 D.升高温度,平衡会向正反应 方向移动
方向移动
练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:
CH4(g)+2NO2(g) N2(
N2( g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,达平衡时CH4 的转化率大于NO2的转化率
18.某有机物结构简式如图,该有机物不可能具有的性质是( )
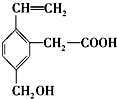

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 能发生酯化反应 | |
| C. | 能在铜作催化剂的条件下发生催化氧化 | |
| D. | 能与4mol溴单质发生加成反应 |
2.以下互为同位素的是( )
| A. | 金刚石与石墨 | B. | D2与H2 | ||
| C. | CO与CO2 | D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl |
9.下列结论均出自《实验化学》中的实验,其中错误的是( )
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
16.过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.请回答相关问题:
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
i.实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2较稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
计算试样中过氧化氢的浓度为0.18mol•L-1.
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
13.下列实验能达到预期目的是( )
| A. | 用酸式滴定管量取20.0mL酸性高锰酸钾溶液 | |
| B. | 用米汤直接检验食盐中是否有碘元素 | |
| C. | 用酚酞检验纯碱中是否含有烧碱 | |
| D. | 多次盐析或多次渗析的方法分离提纯蛋白质 |


 .(其它无机物任选)
.(其它无机物任选)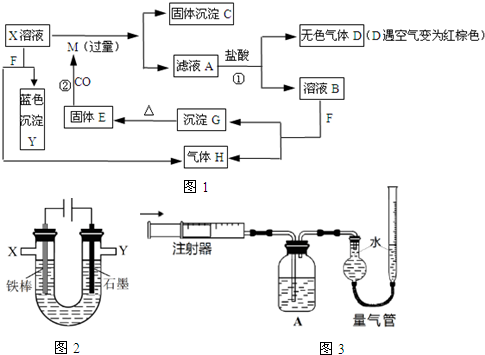
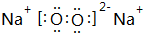 ;G的化学式为Fe(OH)3.
;G的化学式为Fe(OH)3.