题目内容
18.下列叙述不正确的是( )①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1,则氢气的燃烧热为285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | ②④⑥ | B. | ①③⑤⑦ | C. | ②④⑥⑦ | D. | ⑤⑥⑦ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②金属晶体中原子半径越小、金属离子所带电荷越多,金属键的越强,熔点越高;
③金属失电子形成阳离子,与上一周期稀有气体元素的原子具有相同的核外电子排布;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素属于过度元素全部为金属元素;
⑤氢化物分子间含有氢键的沸点较高;
⑥1mol纯净物完全燃烧生成稳定氧化物放出的热量为燃烧热;
⑦分子的稳定性与化学键的键能有关.
解答 解:①非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则热稳定性:HF>H2O>H2S,故①错误;
②金属晶体中原子半径越小、金属离子所带电荷越多,金属键的越强,熔点越高,原子半径:Al<Na<K,则金属键:Al>Na>K,金属键的作用力越弱,熔点越低,则熔点:Al>Na>K,故②正确;
③金属失电子形成阳离子,与上一周期稀有气体元素的原子具有相同的核外电子排布,所以第ⅠA、ⅡA族元素的金属阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布,故③错误;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素属于过度元素全部为金属元素,故④正确;
⑤氢化物分子间含有氢键的沸点较高,则沸点:PH3<AsH3<NH3,故⑤错误;
⑥1mol纯净物完全燃烧生成稳定氧化物放出的热量为燃烧热,已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1,则氢气的燃烧热为285.5kJ•mol-1,故⑥正确;
⑦分子的稳定性与化学键的键能有关,因为白磷中共价键的键能小于氮气中共价键的键能,键能越大,分子越稳定,所以非金属性:P<N,故⑦错误.
故选B.
点评 本题考查元素周期律的递变规律,注意把握元素的性质与对应单质、化合物的性质的关系,题目难度不大,学习中注意积累.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | H2O | B. | KOH | C. | NaCl | D. | NH4Cl |
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 该电池放电时,负极发生还原反应 | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
| A. | 100 mL 2 mol•L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气速率不变 | |
| B. | 铁和稀硫酸反应制取氢气时,改用铁片和浓硫酸可加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->Cl->Br-
④稳定性:HCl>H2S>PH3.
| A. | 都正确 | B. | ①②③ | C. | ②③④ | D. | ①②④ |
| A. | K+、H+、SO42-、CO32- | B. | Na+、Ca2+、SO42-、NO3- | ||
| C. | Ag+、Mg2+、Cl-、S2- | D. | Na+、Cu2+、Cl-、SO42- |
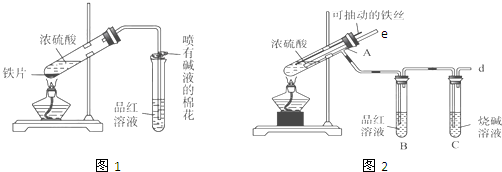
(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
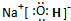 .
.