题目内容
13.苯硫酚(PhSH)是一种用途广泛的有机合成中间体.工业上用常用氯苯(PhCl)和硫化氢(H2S)在高温下反应来制备苯硫酚,但会有副产物苯(PhH)生成.Ⅰ:PhCl(g)+H2S(g)?PhSH(g)+HCl(g)△H1=-16.8kJ•mol-1
Ⅱ:PhCl(g)+H2S(g)═PhH(g)+HCl(g)+$\frac{1}{8}$S8(g) △H2
回答下列问题:
(1)反应Ⅰ为可逆反应,写出平衡常数的表达式K=$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$,反应Ⅱ为不可逆反应,△H2=<0.(填写“>”,“<”,“=”)
(2)上述两个反应的能量变化如图一所示,则在某温度时反应速度v(Ⅰ)> v(Ⅱ).(填写“>”,“<”,“=”)
(3)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图二和图三.
①请解释图二中两条曲线的变化开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动.
②若要提高主产物苯硫酚的产量,可采取的措施是R=2.5,温度控制在590K.
(4)请根据图二、图三,画出恒温恒容条件下反应主产物苯硫酚的物质的量随时间变化的曲线图.

分析 (1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;由图1可知,Ⅱ中反应物总能量高于生成物总能量,反应Ⅱ为放热反应;
(2)活化能越高,反应速率应越慢;
(3)①开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动;
②由图三可知,R=2.5时PhSH浓度最大,由图二可知,温度590K时PhSH浓度最大;
(4)恒温恒容条件下,苯硫酚的物质的量随反应进行浓度增大,到达平衡后浓度大最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,苯硫酚的物质的量减小.
解答 解:(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,反应Ⅰ的平衡常数的表达式K=$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$;由图1可知,Ⅱ中反应物总能量高于生成物总能量,反应Ⅱ为放热反应,故△H<0,
故答案为:$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$;<;
(2)活化能Ⅱ>I,活化能越高,单位体积内活化分子数目越小,反应速率应越慢,故反应速率v(Ⅰ)>v(Ⅱ),
故答案为:>;
(3)①开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动,PhSH的浓度又降低,
故答案为:开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动;
②由图三可知,R=2.5时PhSH浓度最大,由图二可知,温度590K时PhSH浓度最大,故采取措施为:,
故答案为:R=2.5,温度控制在590K;
(4)恒温恒容条件下,苯硫酚的物质的量随反应进行浓度增大,到达平衡后浓度大最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,苯硫酚的物质的量减小,苯硫酚的物质的量随时间变化的曲线图为: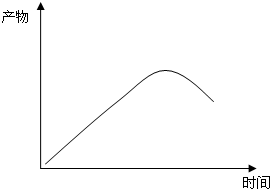 ,
,
故答案为: .
.
点评 本题考查化学反应速率及化学平衡图象综合应用、平衡常数、化学反应能量变化等,是对学生综合能力的考查,难度中等.

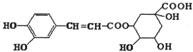
| A. | 该有机物在一定条件下可以发生消去反应 | |
| B. | 1mol该有机物与足量的溴水反应时最多消耗4molBr2 | |
| C. | 该有机物不能使酸性高锰酸钾溶液褪色 | |
| D. | 该有机物在一定条件下可以发生水解反应和酯化反应 |
| A. | 硒元素的非金属性比溴元素的弱 | |
| B. | 硒的最高价氧化物的水化物的分子式为:H2SeO3 | |
| C. | 硒在周期表中位于第五周期VIA族 | |
| D. | 硒的气态氢化物的稳定性比硫化氢强 |
| A. | 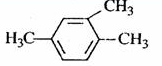 1,3,4-三甲苯 | B. | 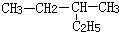 2-乙基丁烷 2-乙基丁烷 | ||
| C. | 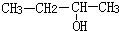 3-丁醇 3-丁醇 | D. | 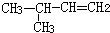 3-甲基-1-丁烯 3-甲基-1-丁烯 |
| Y | Z | M | |
| W |
(2)写出W在周期表中的位置第三周期、IVA族,画出Z的离子结构示意图
 .
.(3)X、Y、Z 三种元素形成的化合物中属于离子化合物的物质的化学式是NH4NO3(或NH4NO2)
(4)W分别与M、Z元素形成的化合物WM4、WZ2分别属于分子 晶体、原子晶体,写出其中沸点较低的物质的电子式
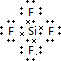
(5)X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的物质的结构式是H-F,稳定性最弱的物质的空间构型是正四面体,
(6)画出Y单质的电子式
 .
.(7)X的单质与Z的单质在KOH的溶液中可以形成原电池,已知A、B均为碳电极,在电池的A极通入X的单质气体,B极通入Z的单质气体,则B极的电极反应式为O2+2H2O+4e-=4OH-.
| A. | X的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性>W的氢化物稳定性 | |
| C. | 化合物X2W2和Y2W3中都不含配位键 | |
| D. | 1 mol ZW2晶体所含Z-W键的数目为4NA |
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<HSO4<HClO4 | D. | 熔点:Na>K>Rb |