题目内容
3.下列有关化学反应速率的说法中正确的是( )| A. | 100 mL 2 mol•L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气速率不变 | |
| B. | 铁和稀硫酸反应制取氢气时,改用铁片和浓硫酸可加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
分析 A、减小溶液的浓度,会使得化学反应速率减慢;
B、铁和浓硫酸反应不会产生氢气,常温下会发生钝化;
C、温度升高,化学反应速率加快;
D、减小压强,反应速率减小;
解答 解:A.加入氯化钠溶液,溶液体积增大,氢离子浓度减小,则反应速率减小,故A错误;
B.浓硫酸具有强氧化性,与铁发生钝化,故B错误.
C.升高温度对反应速率的影响是增多单位体积内活化分子数增多,正逆反应速率都增大,故C错误;
B.减小压强,单位体积活化分子数减小,反应速率减小,故D正确;
故选:D.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
13.一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,关于此电池的推断正确的是( )
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
14.元素周期表与原子结构、元素性质密切相关.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是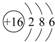 ;④的离子结构示意图
;④的离子结构示意图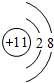 .
.
(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物: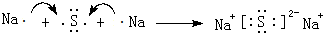 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是
 ;④的离子结构示意图
;④的离子结构示意图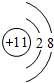 .
.(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物:
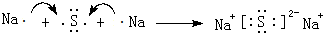 .
.
11.下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
| A. | C3H6、C2H4 | B. | C2H6、C2H6O | C. | C2H4、C2H6O | D. | C3H4、C2H6O |
15.利用相似相溶原理不能解释的是( )
| A. | I2微溶于水,易溶于CCl4;HCl易溶于水 | |
| B. | 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH | |
| C. | 不同的烃之间相互溶解 | |
| D. | I2易溶于KI溶液中 |
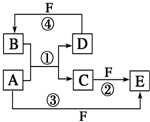 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].