题目内容
【题目】电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
装置 | 实验现象 |
1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3 溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____。
(2)检验另一电极产物的操作及现象是_____。
(3)负极的电极反应式为_____。
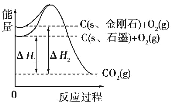
II. 工业上用 Na2SO4 溶液吸收工业烟气中的低浓度 SO2 形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

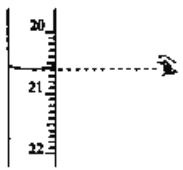
阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是 ____。
(5)阳极区 pH 降低的原因是____。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____。(写出一条即可)
【答案】FeCl2 取少量电解液于试管,加入足量的盐酸酸化的氯化钡溶液,若产生白色沉淀则证明有硫酸钠的生成 SO32-+H2O-2e-=SO42-+2H+ H2O 电极反应生成H+ 阴极电极反应式为SO2+4H++4e-=S+2H2O,阴极区不断消耗氢离子并生成水
【解析】
FeCl3与Na2SO3发生氧化还原反应,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;根据电解池示意图可知,生成氧气的为阳极发生氧化反应,则阴极生成S。
(1)取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,说明有亚铁离子产生,证明FeCl3转化成FeCl2。
(2)另一电极发生氧化反应生成硫酸钠,检验硫酸根离子的操作为取少量电解液于试管,加入足量的盐酸酸化的氯化钡溶液,若产生白色沉淀则证明有硫酸钠的生成。
(3)负极发生氧化反应,亚硫酸钠中硫元素化合价升高发生氧化反应生成硫酸钠,电极反应式为SO32-+H2O-2e-=SO42-+2H+。
(4)根据电解池装置示意图,生成氧气一极为阳极,阳极的pH不断降低可知反应生成H+,据此判断阳极反应为2H2O-4e-=4H++O2,电极反应物是H2O。
(5) 阳极电极反应生成H+,故阳极区 pH 降低。
(6) 阴极发生还原反应,二氧化硫与氢离子反应生成S和水,电极反应式为SO2+4H++4e-=S+2H2O,阴极区不断消耗氢离子并生成水,故pH 升高。

 综合自测系列答案
综合自测系列答案【题目】某兴趣小组探究溶液的 pH 对 KI 与 O2 反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ① 2 mL 1 mol/L KI 溶液+5 滴淀粉 | 5 分钟后无明显变化 |
② 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L HCl 溶液 | 5 分钟后溶液变蓝 | |
③ 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L KCl 溶液 | 5 分钟后无明显变化 | |
④ 2 mL pH=8.5 混有 KOH 的 1 mol/L KI 溶液+5 滴淀粉 | 5 小时后溶液才略变蓝 | |
⑤ 2 mL pH=10混有KOH的1 mol/L KI 溶液+5 滴淀粉 | 5 小时后无明显变化 |
(1)实验①中无现象,可能的原因是:i.KI与O2不反应,ii._____。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是_____。
(3)去掉实验③,对该探究过程_____(填“有”或“没有”)影响。
(4)对比实验②和实验④,可以得出的结论是_____。
(5)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化 I-”,设计了下列装置进行实验⑥,验证猜想。
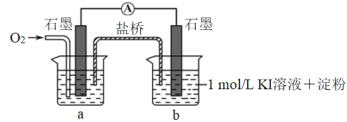
i.烧杯a 中的溶液为_____。
ii. 实验结果是b 中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是_____。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是_____。