题目内容
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
【答案】D
【解析】
A.在含有BaSO4沉淀的溶液中存在平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),加入Na2SO4固体,平衡逆向移动,c(Ba2+)减小,A错误;
Ba2+(aq)+SO42-(aq),加入Na2SO4固体,平衡逆向移动,c(Ba2+)减小,A错误;
B.若强酸为二元强酸,强碱为一元强碱,则混合后酸过量,溶液呈酸性,B错误;
C.含 1mol KOH 的溶液与 1mol CO2完全反应生成碳酸氢钾,由物料守恒知,c(K+)=c(CO32-)+c(HCO3-)+c(H2CO3),C错误;
D.在醋酸钠溶液中,由于CH3COO-水解,使c(CH3COO-)比c(Na+)小些,加入适量醋酸后,醋酸能电离一定量的CH3COO-,有可能出现c(CH3COO-)=c(Na+),D正确;
答案选D。

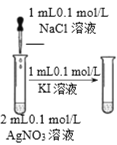
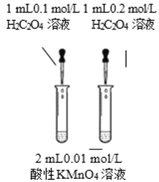
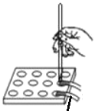
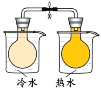
【题目】下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
润湿的pH试纸 |
将 NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI 比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的 pH | 探究温度对化学反应速率的影响 |
A.AB.BC.CD.D
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
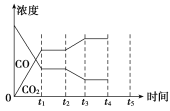
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
【题目】电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
装置 | 实验现象 |
1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3 溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____。
(2)检验另一电极产物的操作及现象是_____。
(3)负极的电极反应式为_____。
II. 工业上用 Na2SO4 溶液吸收工业烟气中的低浓度 SO2 形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是 ____。
(5)阳极区 pH 降低的原因是____。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____。(写出一条即可)