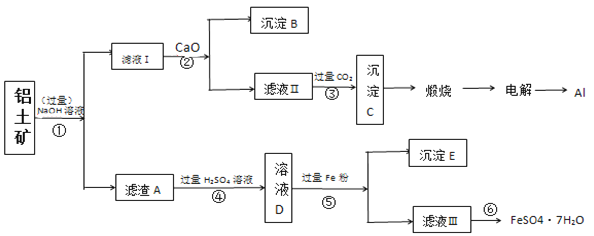
题目内容
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
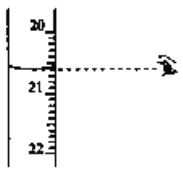
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
【答案】![]() 将
将![]() 氧化为
氧化为![]() 酚酞溶液 20.60mL
酚酞溶液 20.60mL ![]()
![]() 部分溶解在稀硫酸中、
部分溶解在稀硫酸中、![]() 与水反应、+4价硫被氧气氧化等
与水反应、+4价硫被氧气氧化等
【解析】
亚硫酸钠能与强酸反应放出SO2,有较强还原性的SO2能被过氧化氢氧化成硫酸,进而用中和滴定原理分析相关问题。
(1)H2SO3酸性弱于H2SO4,![]() 与稀
与稀![]() 反应的离子方程式
反应的离子方程式![]() ;
;
(2)步骤III中,利用H2O2较强的氧化性,将SO2氧化为![]() ,化学方程式H2O2+SO2=
,化学方程式H2O2+SO2=![]() ;
;
(3)步骤IV中,强碱滴定强酸,可选用酚酞或甲基橙作指示剂。滴定管由上向下读数,精度为0.01mL,故图中液面处读数为20.60mL;
(4)步骤IV中,n(NaOH)=0.01000mol/L×V×10-3L=V×10-5mol,据SO2~![]() ~2NaOH,则Wg样品含
~2NaOH,则Wg样品含![]() 质量:V×10-5mol××64g/mol=3.2×10-4×Vg,1 kg样品中含
质量:V×10-5mol××64g/mol=3.2×10-4×Vg,1 kg样品中含![]() 的质量是3.2×10-4×Vg/(W/1000)=
的质量是3.2×10-4×Vg/(W/1000)=![]() g;
g;
(5)据计算关系式,步骤IV消耗NaOH溶液偏少,使测得亚硫酸盐含量偏低。从步骤II看,是装置中逸出的SO2偏少,可能原因是①SO2溶解度较大,生成的SO2部分溶解于稀硫酸;②部分SO2残留在装置中没有被H2O2溶液吸收;③部分SO2被发生装置中的空气氧化;④装置气密性不良,有SO2逸到空气中。

【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W |
原子半径 | 160 | 143 | 70 | 66 |
主要化合价 |
|
|
|
|
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强