��Ŀ����
��1��������SO2�������ᵼ����ˮ�к��У��ѧʽ������ ��Σ��ֲ��ͽ���������ŷŵ�SO2β���ñ���Na2SO3��Һ���տɵõ���Ҫ����ԭ��NaHSO3����Ӧ�Ļ�ѧ����ʽΪ ��
��2����֪NaHSO3��ˮ��Һ�����ԣ��Ƚ�����SO32����HSO3����H2SO3�������ӵ�Ũ�ȣ� >����������������>������������������
��3��SO2�ǿ������������ָ��֮һ������SO2��ԭKIO3����I2�ķ�Ӧ�ⶨ������SO2������ÿ����0.01mol I2���μӷ�Ӧ��SO2Ϊ�� ����mol��
��4����֪25��ʱ��Ksp(BaSO4)��1.1��10-10��Ksp (BaCO3)��2.6��10-9������˵������ȷ����
A��25��ʱ����BaSO4����Һ�м������ˮ��Ksp(BaSO4)����
B��25��ʱ����BaSO4����Һ�м���Na2CO3��Һ��BaSO4������ת��ΪBaCO3
C����Na2SO4�м������BaCl2��Һ����Һ��c(SO42��)����Ϊ��
��1��H2SO4��H2SO3��2�֣��� SO2+Na2SO3+H2O��2NaHSO3��3�֣�
��2��c(HSO3��)>c(SO32��)>c(H2SO3) ��3�֣�
��3��0.05mol ��3�֣� ��4��BC ����1.5�֣���3�֣�
���������������1��������SO2�������ᵼ����ˮ�к���H2SO3���������Ἣ�ױ������������ᣬ������ˮ�к��е�������H2SO4��H2SO3�������ŷŵ�SO2β���ñ���Na2SO3��Һ���տɵõ���Ҫ����ԭ��NaHSO3����Ӧ�Ļ�ѧ����ʽΪSO2+Na2SO3+H2O��2NaHSO3��
��2����֪NaHSO3��ˮ��Һ�����ԣ���˵��HSO3���ĵ���̶ȴ���HSO3����ˮ��̶ȣ���SO32����HSO3����H2SO3�������ӵ�Ũ�ȴ�С��ϵ��c(HSO3��)��c(SO32��)��c(H2SO3)��
��3��SO2��ԭKIO3����I2���ڷ�Ӧ��SԪ�صĻ��ϼ۴ӣ�4�������¶ȣ�6�ۣ�ʧȥ2�����ӡ���Ԫ�صĻ��ϼ۴ӣ�5�۽��͵�0�ۣ��õ�5�����ӣ�����ݵ��ӵ�ʧ�غ��֪ÿ����0.01mol I2���μӷ�Ӧ��SO2Ϊ ��
��
��4���ܶȻ�����ֻ���¶��й�ϵ������25��ʱ����BaSO4����Һ�м������ˮ��Ksp(BaSO4)���䣬ѡ��A��ȷ��ֻҪ��Һ��c(Ba2��)��c(CO32��)����Ksp (BaCO3)����������̼�ᱵ����������25��ʱ����BaSO4����Һ�м���Na2CO3��Һ��BaSO4�п���ת��ΪBaCO3��ѡ��B����ȷ�����ᱵ����Һ�д����ܽ�ƽ�⣬������Na2SO4�м������BaCl2��Һ����Һ��c(SO42��)�����ܽ���Ϊ�㣬ѡ��C����ȷ����ѡBC��
���㣺����SO2��Σ����SO2β��������������������Һ������Ũ�ȴ�С�Ƚϡ�������ԭ��Ӧ�ļ��㡣�ܶȻ�������Ӧ�ú��й��ж�
�������������е��Ѷȵ����⣬���������ǿ�����۽̲Ļ���֪ʶ���������С���ע�ض�ѧ������֪ʶ���̺�ѵ����ͬʱ�����ض�ѧ�������������ͽ��ⷽ����ָ����ѵ����ּ������ѧ��������û���֪ʶ���ʵ�����������������������ѧ���������������淶�Ĵ���������Ҳ����������ѧ���Ļ���������ʶ��ע��֪ʶ���ܽ�ͻ��ۡ�

��������0. 1 mol/L�����¼�����Һ����H2SO4��Һ��NaHSO4��Һ��CH3COOH��Һ��HCl��Һ��HCN��Һ��NH3��H2O���������¼�����Һ�ĵ����(���Ѿ������ռԭ���ܵİٷ���)���±�(��֪H2SO4�ĵ�һ����������ȫ��)���ش���������:
| ��H2SO4��ҺHSO4- | ��NaHSO4��ҺHSO4- | ��CH3COOH | ��HCl��Һ |
| 10% | 29% | 1.33% | 100% |
��1�������£�pH��ͬ�ı����м�����Һ�������ʵ���Ũ���ɴ�С��˳����(����ţ���ͬ) _
��2�������£���������п��Ͷ�˵����pH=1�ı����м�����Һ�У�����H2�����(ͬ��
ͬѹ��)�ɴ�С��˳����_ _
��3����25��ʱ��������֪Ũ�ȵ�NaOH�ζ�δ֪Ũ�ȵ�CH3 COOHӦѡ��_ ��ָʾ�������յ�ʱ��ҺpH = a������ˮ����ġ�c(H+)Ϊ_ ��
��4����25��ʱ����b mol��L-1��KCN��Һ��0. O1 mol��L-1������������ϣ���Ӧ�ﵽƽ��ʱ�������ҺpH = 7����KCN��Һ�����ʵ���Ũ��b_ 0.01 mol��L-1�>������<����=��);�ú�b�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka=
�Ӻ�ˮ����ȡþ������������þ����Ҫ��Դ����������ȡþ�Ĺ������漰�ļ������ʵ��ܶȻ�����������ѧ��֪ʶ�ش����м������⣺
| ���� | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| �ܶȻ� | 2.8��10�C9 | 6.8��10�C6 | 5.5��10�C6 | 1.8��10�C11 |
(1)�ڴӺ�ˮ����ȡþʱ�������õ�����(��Ҫ�ɷ���̼���)������Ϊ (��ܡ����ܡ�)��������ĥ�ɷ�ĩֱ��Ͷ�뺣ˮ�У������� ���������ֱ��Ͷ�룬Ӧ���������δ�������д����ѧ����ʽ ��
(2)ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ (����ԡ������ԡ�)�õ�Mg(OH)2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ��������� (��ܡ����ܡ�)��Mg2+ת��ΪMg(OH)2������������ (�����ӷ���ʽ��ʾ)��
(3)��֪��ˮ��þ����Ũ��Ϊ1.8��10�C3mol��L�C1����Ҫʹþ���Ӳ�����������Һ��PH���ӦΪ ��
�����£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH�����±���
| ʵ���� | HA���ʵ���Ũ��(mol��L-1) | NaOH���ʵ���Ũ��(mol��L-1) | �����Һ��pH |
| �� | 0.1 | 0.1 | pH��9 |
| �� | c | 0.2 | pH��7 |
| �� | 0.2 | 0.1 | pH��7 |
��ش�
��1���Ӣ������������ HA��ǿ�ỹ������ ��
��2���������������c 0.2 (ѡ�>������<���� ������)�����Һ������Ũ��c(A��) __c(Na��)
(ѡ�>������<���� ������)��
��3�� �Ӣ���ʵ����������˵��HA�ĵ���̶�______NaA��ˮ��̶� (ѡ�>������<���� ��=��)���û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c(OH��)�� mol��L��1��
д���û����Һ��������ʽ�ľ�ȷ���(���������Ƽ���)��
c(Na+)��c(A��)�� mol��L��1�� c(OH��)��c(HA)�� mol��L��1
������ǿ�ᣬ��ѧ�ν�������ˮ��Һ�п�����ȫ���롣����ʵ�ǣ�������ˮ�еĵ�һ����������ȫ�ģ��ڶ������벢����ȫ����������Ϊ:H2SO4=H++HSO4-��HSO4- H+ + S042-��
H+ + S042-��
��ش������й�����:
��1��Na2SO4��Һ��_(������ԡ��������ԡ��������ԡ�)����������_
(�����ӷ���ʽ��ʾ)��
��2��H2SO4��Һ��BaC12��Һ��Ӧ�����ӷ���ʽΪ_ ��
��3����0��l0mol��L-1��Na2SO4��Һ�У���������Ũ�ȹ�ϵ��ȷ����_ (��д���)��
| A��c(Na+)=c(SO42-)+c��HSO4һ)+c(H2SO4) |
| B��c(OH-)="c(" HSO4-)+c(H+) |
| C��c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D��c( Na+)=2c(SO42-)+2c(HSO4-) |
��5����25��ʱ��0��10 mol��L-1H2SO4��Һ��pH=-lg0��11����0��10 mol��L-1��H2SO4��Һ��c(SO42-)= mol��L-1
��ҵ�������̿�Ϊԭ�ϣ������ս������е�SO2�Ʊ�MnSO4��H2O���������£�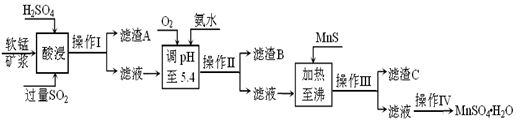
ij���̿����Ҫ�ɷ�ΪMnO2��������Si(16.27%)��Fe(5.86%)��Al(3.42%)��Zn(2.68%)��Cu��0.86%����Ԫ�صĻ����������̷�����Ӧ��MemOn+H+��Me��2n/m��++H2O��Me��ʾFe�� Al�� Zn�� Cu�ȡ�25��ʱ����������������������������ʽ��ȫ����ʱ��Һ��pH���±���
| ������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ��-0.42 | ��2.5 | ��7 | ��7 |
�ش��������⣺
��1�����ʱSO2��MnO2��ԭΪMnSO4�������ӷ���ʽΪ ���� ��
���ʱSO2����������pH���¶ȵĹ�ϵ����ͼ��Ϊ���SO2�������ʣ�������˵��������������������� ������
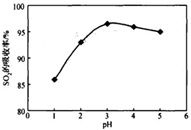
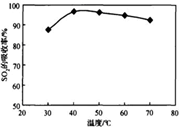
ͼ1�� SO2���������� pHֵ�Ĺ�ϵ �� ͼ2�� SO2�����������¶ȵĹ�ϵ
��2������B����Ҫ�ɷ��� ���� ��
��3������MnS��Ŀ���� �� ������������ ��
��4������IV�IJ���Ϊ���������������������������������ˡ�ϴ�ӡ����
��5��MnO2����������֮һ����ʯīΪ�缫���ڲ��Ͻ�������£�����ữ��MnSO4��Һ�������ĵ缫��ӦʽΪ�������� ������������������
��6����֪��������Ũ��С��1.0��10��5mol/Lʱ��Ϊ�Ѿ���ȫ���������ݱ������ݣ�����25��ʱZn(OH)2�ܶȻ�KspΪ �����������̣�������������λ��Ч���֣���
[14��]��֪��I2��2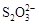

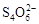 ��2I�D��������ʵ��ܶȻ��������±���
��2I�D��������ʵ��ܶȻ��������±���
| ���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2?2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2?2H2O����ò���������ˮCuCl2��ԭ����_______________�����û�ѧ����ʽ��ʾ������CuCl2?2H2O����õ�������ˮCuCl2�ĺ���������_______��
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2?2H2O�������������������I�D������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
�ٿ�ѡ��___________���ζ�ָʾ�����ζ��յ��������_________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ______________________________��
�۸�������CuCl2?2H2O�������ٷ���Ϊ___________________________��
ijͬѧ��0.10 mol/L��HCl��Һ�ⶨδ֪Ũ�ȵ�NaOH��Һ����ʵ��������£�
| A������ʽ�ζ�����ȡ20.00 mL HCl��Һע����ƿ��ͬʱ�μ�2-3�η�̪��Һ�� |
| B����0.10 mol/L��HC!��Һ��ϴ��ʽ�ζ��ܣ� |
| C���ѵζ���������ˮϴ���� |
| D��ȡ�¼�ʽ�ζ��ܣ��ô���NaOH��Һ��ϴ������NaOH��Һע���ʽ�ζ���������̶ȡ�0������20 cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ�棻 |
F����ȡ��ƿ�����ظ����ϲ���1-2�Σ�
G������ƿ���ڼ�ʽ�ζ����±ߣ�ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿ��ֱ���������һ�μ�Һ����Һ��ɫͻ�䲢�ڰ�����ڲ��ٱ�ɫΪֹ�����µζ���Һ�����ڵĿ̶ȡ�
��ش��������⣺
��1���ζ���������ȷ˳���ǣ�(����ĸ) ��C�� ��B�� �� �� ��
��2��G������������ƿ�µ�һ�Ű�ֽ�������� ��
��3��D��������Һ��Ӧ���ڵ� �����첿��Ӧ ��
��4���ζ��յ����ʱ���������Һ�棬��������ֵ �����ζ�ǰƽ�Ӷ������ɴ˼���õ���NaOH��ҺŨ�� (�ƫ����ƫС��������Ӱ�족)
��5����ͼ�ֱ�����Ͳ���ζ��ܡ��¶ȼƵ�һ���֣�����Ͳ���ζ��ܣ��¶ȼƷֱ��� (����)��
