题目内容
铁是地壳中含量第二的金属元素,其单质、合金化合物在生产生活中的应用广泛。
(一)工业废水中有一定量的Cr2O72--和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是____________________________________________________。
(2)阴极附近溶液pH升高的原因是___________(用电极反应式解释);溶液中同时生成的沉淀还有___________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁涉及的主要生产流程如下: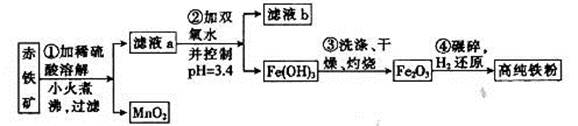
已知:①某赤铁矿石含60.0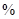 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
(3)步骤②中加双氧水的目的是__________________,pH控制在3.4的作用是_______________________;已知25℃时,Ksp[Cu(OH) 2] =2.0×10-20,该温度下反应:Cu2++2H2O Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。
(4)如何判断步骤③中沉淀是否洗涤干净?_____________________________________。
(14分)
(1)提供还原剂Fe2+(2分)
(2)2H++2e-=H2↑ (或2H2O-2e-= H2↑+2OH-)(2分);Fe(OH)3 (1分)
(3)将溶液中的Fe2+氧化成Fe3+(1分);使溶液中的Fe3+完全沉淀,而其他金属离子不沉淀(1分);
5.0×10-9(2分)
(4)取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无白色沉淀生成,则表明沉淀已洗净(2分)
解析试题分析:
(1)Fe作电极的目的是提供还原剂Fe2+与Cr2O72-反应。
(2)H+在阴极放电:2H++2e-=H2↑,导致附近溶液pH升高;
附近溶液pH升高使得Fe3++3H2O Fe(OH)3+3H+,平衡正移出现Fe(OH)3沉淀,
Fe(OH)3+3H+,平衡正移出现Fe(OH)3沉淀,
(3)根加双氧水的目的是将溶液中的Fe2+氧化成Fe3+,通过调节pH到3.4除去Fe3+;Ksp[Cu(OH) 2] =c(Cu2+)×c2(OH-)=2.0×10-20, K= c2(H+)/ c(Cu2+)=K2W/ Ksp[Cu(OH) 2]= 5.0×10-9。
(4)检验方法:取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无白色沉淀生成,则表明沉淀已洗净
考点:本题考查氧化还原、沉淀的生成、化学实验、电池等相关知识。。

 阅读快车系列答案
阅读快车系列答案常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析, HA是强酸还是弱酸 。
(2)②组情况表明,c 0.2 (选填“>”、“<”或 “=”)。混合液中离子浓度c(A-) __c(Na+)
(选填“>”、“<”或 “=”)。
(3) 从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (选填“>”、“<”或 “=”),该混合溶液中离子浓度由大到小的顺序是 。
(4)①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)= mol·L-1; c(OH-)-c(HA)= mol·L-1
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下: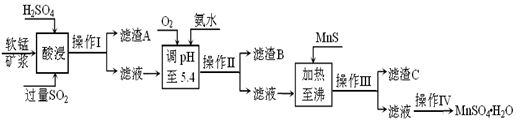
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。
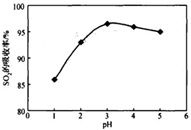
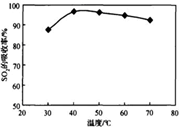
图1: SO2的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
[14分]已知:I2+2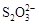

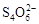 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2?2H2O晶体。
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是_______________。(用化学方程式表示)。由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2?2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2?2H2O的质量百分数为___________________________。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: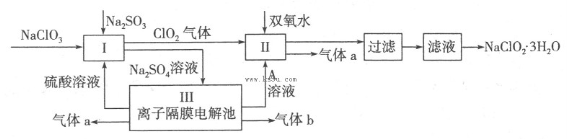
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)该实验应选用 作指示剂。
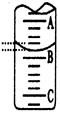
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不用化简):C1= mol/L。
某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。