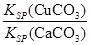题目内容
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下: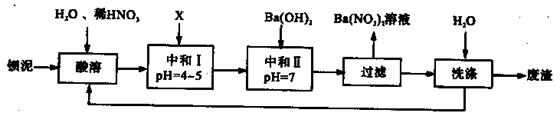
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.lxl0-10, KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________ 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 (填序号);
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
(1)BaSO4(S)+CO32-(aq)  BaCO3(S)+SO42-(aq)(2分)
BaCO3(S)+SO42-(aq)(2分)
(2)Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)2+4H2O(2分)
(3)B(2分) (4)使Fe2+完全沉淀;(2分)Fe3++3H2O Fe(OH)3+3H+,BaCO3消耗H+,使Fe3+水解平衡右移,形成Fe(OH)3沉淀。(2分)(5)蒸发结晶(2分)(6)
Fe(OH)3+3H+,BaCO3消耗H+,使Fe3+水解平衡右移,形成Fe(OH)3沉淀。(2分)(5)蒸发结晶(2分)(6) (2分)
(2分)
解析试题分析:(1) BaSO4沉淀在饱和Na2CO3溶液中转化为BaCO3,离子方程式为BaSO4(S)+CO32-(aq)  BaCO3(S)+SO42-(aq);(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,分别为Ba(NO3)2和Fe(NO3)2;方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)2+4H2O;(3)结合本厂实际;BaCO3既是本厂产品,来源广,同时又能消耗H+,调节pH,选择B;(4)(5)见答案;(6)Ba(NO3)2晶体与硫酸反应生成BaSO4,n(BaSO4)=n(Ba(NO3)2)=
BaCO3(S)+SO42-(aq);(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,分别为Ba(NO3)2和Fe(NO3)2;方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)2+4H2O;(3)结合本厂实际;BaCO3既是本厂产品,来源广,同时又能消耗H+,调节pH,选择B;(4)(5)见答案;(6)Ba(NO3)2晶体与硫酸反应生成BaSO4,n(BaSO4)=n(Ba(NO3)2)= m(Ba(NO3)2)=
m(Ba(NO3)2)= 则纯度为
则纯度为
考点:考查沉淀溶解平衡、元素化合物性质、基本实验操作、计算

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp(mol2·L-2) | 3×10-9 | 9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④向沉淀中加入足量的盐酸。
(1)步骤①所得悬浊液中[Ca2+]=________ mol·L-1
(2)写出第②步发生反应的离子方程式:________________________________.
(3)设计第③步的目的是________________________________________________.
(4)第④步操作发生的现象为: 。
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: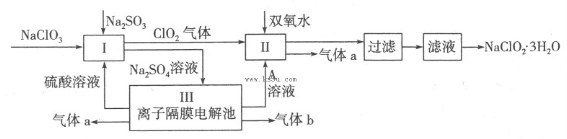
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)该实验应选用 作指示剂。
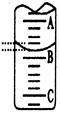
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不用化简):C1= mol/L。
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装c mol/L盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积 mL。
②下表是4种常见指示剂的变色范围: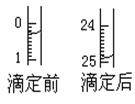
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0—8.0 | 3.1—4.4 | 4.4—6.2 | 8.2—10.0 |
该实验应选用 作指示剂;
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | | | |
| 3 | V | 6.00 | 31.35 | 25.35 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)c = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
A.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
B.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
如图所示装置中,a?b都是惰性电极,通电一段时间后(电解液足量),a极附近溶液显红色?下列说法正确的是
| A.a是负极,b是正极 |
| B.CuSO4溶液的pH逐渐减小 |
C.铜电极上的反应式为 |
| D.向NaCl溶液中加入一定量的盐酸,能使溶液与原来溶液完全一样 |
 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
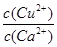 >
>