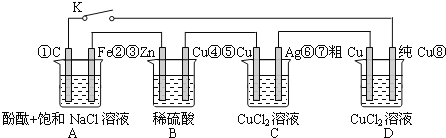
题目内容
【题目】已知25℃时有关弱电解质的电离平衡常数:
弱电解质化学式 | CH3COOH | NH3·H2O | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃时,下列有关电解质溶液的说法不正确的是
A.pH相等的四种溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液与2L0.25mo·L-1NH4Cl溶液,前者含NH4+物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
【答案】B
【解析】
A.NaOH是强碱,相同浓度的4种溶液氢氧化钠的pH最大,所以pH相同的三种溶液中,氢氧化钠浓度最低;根据表中电离平衡常数可知酸性:CH3COOH>H2CO3> ![]() ,所以水解程度:
,所以水解程度:![]() >
>![]() >CH3CO-,当四种溶液的pH相同时,四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a,故A不符合题意;
>CH3CO-,当四种溶液的pH相同时,四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a,故A不符合题意;
B.NaHCO3溶液呈碱性,![]() 的水解程度大于其电离程度:则c(H2CO3)>c(
的水解程度大于其电离程度:则c(H2CO3)>c(![]() ),正确的粒子浓度大小为:c(Na+)>c(
),正确的粒子浓度大小为:c(Na+)>c(![]() )>c(H2CO3)>c(
)>c(H2CO3)>c(![]() ),故B符合题意;
),故B符合题意;
C.NH4Cl 浓度越小,![]() 水解程度越大,不考虑水解1L0.50molL-1NH4Cl溶液与2L0.25molL-1NH4Cl溶液铵根的物质的量相同,但0.25molL-1NH4Cl 溶液中铵根水解程度大,所以含
水解程度越大,不考虑水解1L0.50molL-1NH4Cl溶液与2L0.25molL-1NH4Cl溶液铵根的物质的量相同,但0.25molL-1NH4Cl 溶液中铵根水解程度大,所以含![]() 物质的量前者大,故C不符合题意;
物质的量前者大,故C不符合题意;
D.浓度相同时醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+)>c(CH3COOH),溶液中存在c(CH3COO-)+c(OH-)=c(H+)+c(Na+),则c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D不符合题意;
故答案为:B。