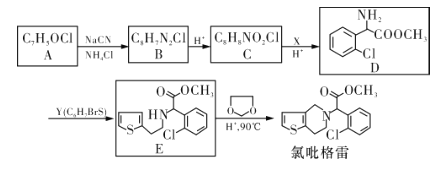
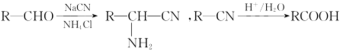题目内容
【题目】在两个固定体积均为1 L密闭容器中以不同的氢碳比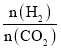 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
A.该反应在常温下不可能自发进行
B.氢碳比,X<2.0
C.若起始时CO2、H2浓度分别为0.5 mol·L-1、1.0 mol·L-1,则可得P点对应温度的平衡常数的值为512
D.向P点状态的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,再次平衡后α(CO2)减小
【答案】C
【解析】
A.由图可知,随温度升高CO2的平衡转化率减小,说明升高温度,平衡逆向移动,则正反应为放热反应,故△H<0,反应的熵变△S<0,若△H-T△S<0,则需在低温下进行,故A错误;
B.氢碳比[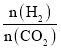 ]越大,二氧化碳的转化率越大,根据图像,氢碳比:X>2.0,故B错误;
]越大,二氧化碳的转化率越大,根据图像,氢碳比:X>2.0,故B错误;
C.由图可知,P点平衡时二氧化碳转化率为0.5,氢碳比[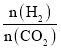 ]=2,起始时氢气为1mol/L、二氧化碳为0.5mol/L,则二氧化碳浓度变化量为0.25mol/L,则:
]=2,起始时氢气为1mol/L、二氧化碳为0.5mol/L,则二氧化碳浓度变化量为0.25mol/L,则:
2CO2(g)+6H2 (g)C2H4(g)+4H2O(g)
起始浓度(mol/L):0.5 1 0 0
变化浓度(mol/L):0.25 0.75 0.125 0.5
平衡浓度(mol/L):0.25 0.25 0.125 0.5
代入平衡常数表达式K= =
=![]() =512,故C正确;
=512,故C正确;
D.P点平衡时,CO2、H2、C2H4、H2O的浓度比值为2∶2∶1∶4,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,增大了氢气的浓度,平衡正向移动,二氧化碳的转化率增大,即再次平衡后a(CO2)增大,故D错误;
故选C。

【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
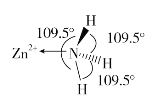
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
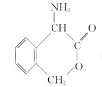
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
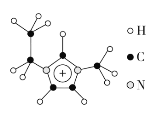
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
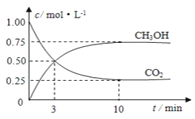
(5)Zn与S形成某种化合物的晶胞如图所示。
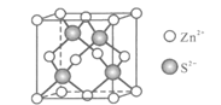
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
【题目】已知25℃时有关弱电解质的电离平衡常数:
弱电解质化学式 | CH3COOH | NH3·H2O | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃时,下列有关电解质溶液的说法不正确的是
A.pH相等的四种溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液与2L0.25mo·L-1NH4Cl溶液,前者含NH4+物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)