题目内容
【题目】某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:

(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于____中(填“甲”或“乙”);G管可以用化学实验室里的一种常用仪器代替,你认为这种仪器的名称是____。仪器甲、乙接口的连接方式如下:A连接___,C连接F;(填写接口的编号)
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是_______。
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是___。
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
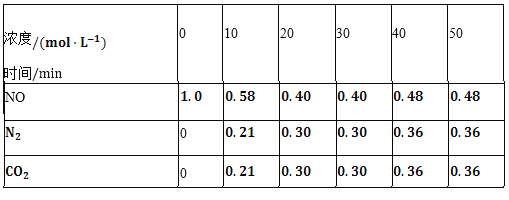
③根据以上数据得出Na2SO3的质量分数为_____。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是______,验证方法__________。
【答案】乙 碱式滴定管 D 洗涤、干燥(或烘干) B (126b/217a)×100% Na2SO3变质 取少量试样于试管中配成溶液,先滴加适量稀盐酸,再滴加BaCl2溶液,若有白色沉淀生成,则证明该Na2SO3变质
【解析】
某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,倒置盛稀硫酸的试管,发生反应,因家中有直观可使气体逸出,也可是溶液溢出,不能盛放稀硫酸,,故稀硫酸只能盛放在乙中;G管可以用化学实验室里的一种常用仪器代替,起作用可吸收二氧化硫,还能定量测定,故该仪器为碱式滴定管;为便于硫酸流下,故仪器甲、乙接口的连接方式为A与D相连,C连接F;
(2)用沉淀法测定Na2SO3的质量分数,由实验流程可知加过量的氯化钡使生成亚硫酸钡沉淀,操作Ⅰ 为过滤,沉淀A为BaSO3,若变质则会混有硫酸钡,则
①操作Ⅱ为洗涤、干燥后称量固体质量即可测定质量分数;
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量,主要是看溶液中是否还有SO32—;故需用试剂BaCl2溶液,操作为待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量,SO32-沉淀完全,故B项正确;
③沉淀A为BaSO3,物质的量为:![]() ,故Na2SO3的质量分数=
,故Na2SO3的质量分数=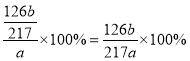 。
。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,可能该Na2SO3变质,故验证方法为:取少量试样于试管中配成溶液,先滴加适量稀盐酸,再滴加BaCl2溶液,若有白色沉淀生成,则证明该Na2SO3变质。

【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
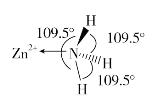
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
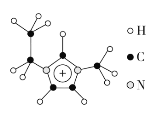
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
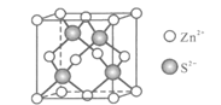
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
【题目】已知25℃时有关弱电解质的电离平衡常数:
弱电解质化学式 | CH3COOH | NH3·H2O | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃时,下列有关电解质溶液的说法不正确的是
A.pH相等的四种溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液与2L0.25mo·L-1NH4Cl溶液,前者含NH4+物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)