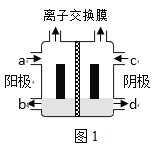
题目内容
【题目】铜元素在化合物中其化合价可以呈现![]() 、
、![]() 价。
价。![]() 和
和![]() 是常见的
是常见的![]() 价铜的化合物,
价铜的化合物,![]() 是较为常见的
是较为常见的![]() 价铜的化合物。
价铜的化合物。
(1)铜元素位于周期表的_______区。属于________族。
(2)请写出![]() 的电子排布式__________________,S的价层电子排布图______________
的电子排布式__________________,S的价层电子排布图______________
(3)向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较
溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较![]() 和
和![]() 中
中![]() 中键角的大小:
中键角的大小:![]() ___________
___________![]() (填“
(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)![]() 中阴离子的空间构型为_______
中阴离子的空间构型为_______
(5)![]() 的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
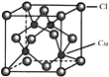
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②若以铜原子为顶点构成晶胞,面心原子为________(Cu、Cl)
【答案】ds IB 1s22s22p63s23p6 3d10 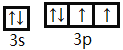 [Cu(NH3)4]SO4H2O < 平面三角形 4 Cu
[Cu(NH3)4]SO4H2O < 平面三角形 4 Cu
【解析】
(1)铜为29号元素,据此书写铜原子的电子排布式,并判断在周期表中的位置;
(2) 根据铜原子的电子排布式书写![]() 的电子排布式;S是16号元素,结合电子排布式书写价层电子排布图;
的电子排布式;S是16号元素,结合电子排布式书写价层电子排布图;
(3))[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4H2O;NH3中N原子含有3个共价键和1个孤电子对,[Cu(NH3)2]+中N原子形成4个共价键,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力;
(4)根据价层电子对个数=σ键个数+孤电子对个数分析判断NO3-的空间构型;
(5)①晶胞中Cu原子数与Cl原子数为1∶1,故配位数相等,根据Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4解答;
②晶胞中Cu原子与Cl原子的数目相等,在图示晶胞中C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心,若以铜原子为顶点构成晶胞,则Cu和C1原子位置互换,据此解答。
(1)铜为29号元素,电子排布式为1s22s22p63s23p6 3d104s1,位于周期表的ds区。属于IB族元素,故答案为:ds;IB;
(2) 铜为29号元素,电子排布式为1s22s22p63s23p6 3d104s1,则![]() 的电子排布式为1s22s22p63s23p6 3d10,S是16号元素,电子排布式为1s22s22p63s23p4,价层电子排布图为
的电子排布式为1s22s22p63s23p6 3d10,S是16号元素,电子排布式为1s22s22p63s23p4,价层电子排布图为 ,故答案为:1s22s22p63s23p6 3d10;
,故答案为:1s22s22p63s23p6 3d10; ;
;
(3) 向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4H2O;NH3中N原子含有3个共价键和1个孤电子对,[Cu(NH3)2]+中N原子形成4个共价键,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,NH3与Cu+形成配位键,N-H键斥力减小,键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小,故答案为:Cu(NH3)4SO4H2O;<;
溶液中滴加氨水,可以得到深蓝色的溶液,再向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4H2O;NH3中N原子含有3个共价键和1个孤电子对,[Cu(NH3)2]+中N原子形成4个共价键,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,NH3与Cu+形成配位键,N-H键斥力减小,键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小,故答案为:Cu(NH3)4SO4H2O;<;
(4)NO3-中N原子孤电子对数=![]() =0,价层电子对数=3+0=3,离子空间构型为平面三角形,故答案为:平面三角形;
=0,价层电子对数=3+0=3,离子空间构型为平面三角形,故答案为:平面三角形;
(5)①晶胞中Cu原子数目为4,由化学式可知晶胞中Cl原子数目也是4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4,故Cl原子配位数也是4,即每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为4,故答案为:4;
②根据①的分析,晶胞中Cu原子数目为4,由化学式可知晶胞中Cl原子数目也是4,二者原子数目为1∶1,在题示晶胞中C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心,若以铜原子为顶点构成晶胞,则Cu原子位于立方体的顶点和面心,C1原子位于Cu原子构成的四面体体心,故答案为:Cu。